Atomtallet, symbolisert med bokstaven Z, tilsvarer mengden protoner som finnes i atomkjernen til et gitt kjemisk element. For eksempel er atomnummeret til hydrogen 1, noe som betyr at det bare har 1 proton i atomkjernen.
Atomtallet vises vanligvis ved siden av det kjemiske elementets tegnsymbol (i nedre hjørne) til venstre. Eksempel: 1H.
I jordtilstanden er atomnummeret lik antall elektroner, siden elementet er i denne tilstanden nøytral, derfor må mengden positive ladninger (protoner) være lik mengden av negative ladninger (elektroner) til atom.
Atomtallet er viktig fordi det er han som bestemmer hovedegenskapene og egenskapene til elementet, samt dets oppførsel og plassering i det periodiske systemet. Elementene er oppført i det periodiske systemet i stigende rekkefølge av atomnummer, som vanligvis vises over elementet, som vist nedenfor. Merk at det første elementet er hydrogen, H (Z = 1), etterfulgt av helium, He (Z = 2), så kommer litium, Li (Z = 3), og så videre.
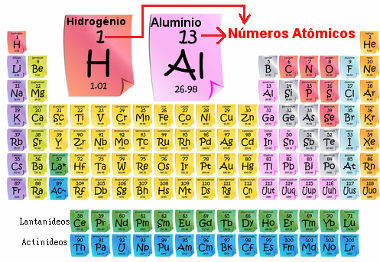
Atomisk antall elementer i det periodiske systemet
Vi kan til og med konseptualisere et kjemisk element som værende “Et sett med atomer som har samme atomnummer”. Når vi for eksempel snakker om det kjemiske elementet oksygen, snakker vi om atomer med atomnummer 8. Nedenfor har vi atomene til de kjemiske elementene fra periodene 1 og 2 i det periodiske systemet i stigende rekkefølge av atomnummer:

Kjemiske elementer fra perioder 1 og 2 i periodisk tabell i stigende rekkefølge av atomnummer
Ikke stopp nå... Det er mer etter annonseringen;)
Atomtallene ble opprinnelig definert av den engelske fysikeren Henry Gwyn Jeffreys Moseley (1887-1915), og da han utførte eksperimenter som involverte bombardement av forskjellige elementer kjemikere med røntgenstråler, observerte han at kvadratroten til frekvensen av røntgenstrålene produsert ved utslipp av atomkjernen var direkte proporsjonal med atomnummeret til elementet i tabellen. Periodisk. Med dette konkluderte han med at atomnummeret var relatert til atomenes egenskaper fordi det representerte antall positive ladninger i kjernen til hvert atom.
Kjemiske bindinger påvirker ikke atomantallet, da de bare involverer elektroner som er i elektrosfæren. Imidlertid involverer kjernefysiske reaksjoner atomkjernen, og dermed er også atomnummeret inkludert.
For eksempel når partikler (hovedsakelig moderate nøytroner) bombes på en tung, ustabil atomkjerne, er den kjernen ødelagt og gir opphav til to mindre atomkjerner, det vil si med et mindre antall protoner og nøytroner som frigjør en kolossal mengde energi.
Kjernefusjon, derimot, er den motsatte prosessen, det er når to små og lette kjerner forenes, med en større og mer stabil kjerne som frigjør en enda større mengde energi.
Når disse kjernefysiske reaksjonene oppstår, stammer altså nye kjemiske elementer, ettersom atomnumrene til de opprinnelige elementene er forskjellige fra atomnumrene til de endelige elementene. Se for eksempel nedenfor at splittelsen av uran-235 med atomnummer 92 gir opphav til barium (Z = 56), krypton (Z = 36) og tre nøytroner:

Uranium-235 kjernefysisk fisjonreaksjon
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Hva er atomnummer?"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-atomico.htm. Tilgang 27. juni 2021.