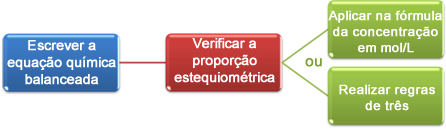
Elektrolyse det er en ikke-spontan prosess, det vil si en som ikke forekommer naturlig, der stoffer dannes ved hjelp av elektrisk utladning i forbindelser smeltet eller oppløst i vann. I denne prosessen når en elektrisk strøm en glassbeholder (elektrolytisk tank) som har to inerte elektroder (som ikke lider eller oksidasjon heller ikke reduksjon) dannet av grafitt eller platina. Disse elektrodene er koblet til en elektrisk kilde (vanligvis en trommer) og dyppet i et salt eller en base smeltet eller oppløst i vann. Akkurat som batteri, har elektrolyse en katode (hvor reduksjon oppstår) og en anode (der oksidasjon oppstår).
Sammendrag
Elektrolyse er en ikke-spontan prosess;
Enkle eller sammensatte stoffer kan dannes;
Det kan forekomme med en smeltet løsemiddel (magmatisk elektrolyse);
Det kan oppstå med et oppløst stoff oppløst i vann (vandig elektrolyse);
Et kation gjennomgår alltid reduksjon ved katoden;
En anion gjennomgår alltid oksidasjon ved anoden.
Se også:Å skaffe aluminium fra elektrolyse

Typer elektrolyse
Det er en elektrolyse som oppstår når en elektrisk utladning utføres på en smeltet ionisk forbindelse. Den ioniske forbindelsen er en dannet av en ionisk binding, slik som en salt eller a utgangspunkt uorganisk. Når vi snakker om smeltet forbindelse, viser vi i sin tur til forbindelsen som går fra et fast stoff til en flytende tilstand.
- Eksempel på magmatisk elektrolyse
Når vi utfører fusjonen av kaliumklorid (KCl), gjennomgår dette saltet dissosieringsprosessen og frigjør kaliumkation (K+) og jodidanionet (l-).

Dissosiasjonsligning for kaliumklorid
Når den elektriske strømmen når den elektrolytiske cellen med disse ionene, reduseres kaliumkationen og danner metallisk kalium (K), og jodidanionen oksyderes og danner fast jod (I2).
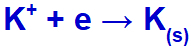
Solid ligning av kaliumdannelse
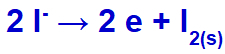
Solid jodedannelsesligning
Det er en elektrolyse som oppstår når den elektriske utladningen utføres på en vandig løsning (har vann) dannet av et salt eller en uorganisk base.
- Eksempel på vandig elektrolyse
Når vi løser opp natriumklorid i vann, dissosieres det, og vannet gjennomgår ionisering:

Vannionisering og natriumkloriddissosiasjonsligninger
Som natriumkation (Na+) tilhører IA-familien, hydroniumkationen (H+) passerer gjennom utslippet og gjennomgår reduksjon og danner hydrogengass (H2).
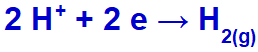
Hydrogengassdannelsesligning
Som klorid (Cl-) er ikke oksygenert (har ikke oksygen) og er ikke fluor (F-), slippes den ut og oksiderer og danner klorgass (Cl2).

Klorgassdannelsesligning
Selektiv ionutslipp
Under en elektrolyseprosess i et vandig medium (oppløsning dannet av vann og et løst stoff), vil vi alltid ha to kationer: hydronium, fra vann og andre, fra salt dissosiasjon (et eksempel på løsemiddel). Vi vil også ha to anioner: hydroksylen, som kommer fra vann, og en annen som kommer fra salt.

Ioner fra vannionisering og saltdissosiasjon
- Selektiv utslipp for kationer og anioner
Hvis kationen fra det oppløste stoffet tilhører IA-, IIA- eller IIIA-familien, er hydronium (H+) vil bli redusert;
Hvis kationen som kommer fra løsemidlet ikke tilhører familiene nevnt ovenfor, vil det lide reduksjonen.
Hvis anionet fra det oppløste stoffet har oksygen i sammensetningen eller er et fluor (F-), hydroksydet (OH-) vil gjennomgå oksidasjon;
-
Hvis anionet fra det oppløste stoffet ikke har de ovennevnte egenskapene, vil det gjennomgå oksidasjon.
Ikke stopp nå... Det er mer etter annonseringen;)
Det er kjent at vann har evnen til selvionisering og produserer hydroniumioner (H+) og hydroksyd (OH-), men denne ioniseringen er ganske begrenset. Dette faktum er bevist av ineffektiviteten av rent vann til å lede elektrisk strøm.
Som for eksempel elektrolyse innebærer elektrisk utladning, for å utføre elektrolyse av vann, er det nødvendig å oppløse et oppløst stoff, det som favoriserer selektiv utslipp av hydronium og hydroksid (som vist i emnet om utslipp selektiv).
Hvis vi tilsetter natriumsulfat (Na2KUN4), for eksempel, vil vi ha natriumkationene i midten (Na+) og hydronium (H+), så vel som hydroksidanioner (OH-) og sulfat (SO4-2). Dermed når den elektriske strømmen ankommer den elektrolytiske tanken:
hydronium vil slippes ut, redusere, fordi natrium tilhører IA-familien;
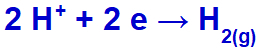
Hydrogengassdannelsesligning
hydroksydet vil gjennomgå utslipp, oksiderende, fordi sulfatet har oksygen i sammensetningen.
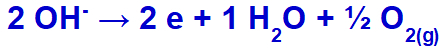
Oksygengasdannelsesligning
Når de to ionene (kation og anion) som kommer fra vannet ble sluppet ut, sier vi at elektrolysen av vannet fant sted.
Se også: Kvantitative aspekter ved elektrolyse
Produksjon av enkle stoffer som hydrogengass (H2), oksygengass (O2) etc.;
Produksjon av sammensatte stoffer som natriumhydroksid (NaOH), svovelsyre (H2KUN4) etc;
Belegg en del med et bestemt metall, slik som kobber (kobber) og gull (gullbelegg);
Bruk for å fjerne et bestemt metall fra malmen.
Løste øvelser på elektrolyse
Eksempel 1 - (Vunesp) En vandig løsning av CuCℓ2 blir utsatt for elektrolyse ved bruk av platinaelektroder. Den riktige påstanden er:
a) Cu-ionreduksjon skjer ved katoden2+.
b) Cu-ionoksidasjon skjer ved anoden2+.
c) Klorgass dannes ved katoden.
d) En del av platinaanoden oppløses og danner Pt2+.
e) Produktene fra denne elektrolysen vil være forskjellige hvis elektrolysen av CuCl2 var brennende (fusjon).
a) Korrekt. Når CuCl2 er oppløst i vann, har vi hydroniumkationene (H+) og kobber II (Cu+2). Siden kobber II-kationen ikke tilhører familiene IA, IIA og IIIA, reduseres den.
b) Falske, ettersom kloridanionet (Cl) oksyderes ved anoden-), som ikke har oksygen i sammensetningen og ikke er fluor (F-).
c) Usant, fordi reduksjonen av kobber II-kationen skjer ved katoden, er det derfor dannelsen av kobbermetallet.
d) Falske, ettersom platina- eller grafittelektroder i elektrolyse bare leder elektrisitet, deltar de ikke i prosessen.
e) Falsk, som den magmatiske elektrolysen av kobberklorid II (CuCl2) ville presentere nøyaktig de samme produktene som den vandige, ettersom de tilstedeværende ionene ville være kobber II (Cu+2) og kloridet (Cl-1).
Eksempel 2 (UFRN) Vurder følgende systemer:
JEG. Smeltet natriumklorid;
II. Vandig natriumkloridoppløsning;
III. Smeltet natriumhydroksid;
IV. Vandig natriumhydroksydløsning.
De som kan gi natrium, når de blir utsatt for elektrolyse, er:
a) bare I og II.
b) bare I og III.
c) bare II og IV.
d) bare III og IV.
e) I, II, III og IV.
Systemene som leverer metallisk natrium som produkt ved katoden er I og III.
I- Den eneste kationen som er tilstede i mediet er natriumkationen, og derfor kan den bare redusere og danne metallisk natrium.
II- Dette systemet gir ikke metallisk natrium fordi natriumkloridet var oppløst i vann, og derfor har vi nærvær av natriumkationer (Na+) og hydronium (H+) - dette er den som lider av reduksjonen, ettersom natrium tilhører IA-familien.
III- Den eneste kationen som er tilstede i mediet er natriumkationen (fordi materialet har blitt utsatt for en fusjon), derfor gjennomgår det bare reduksjon og danner metallisk natrium;
IV- Dette systemet gir ikke metallisk natrium fordi natriumhydroksydet ble oppløst i vann, så i midten har vi nærvær av natriumkationer (Na+) og hydronium (H+) - dette er den som lider av reduksjonen, ettersom natrium tilhører IA-familien.
Av meg. Diogo Lopes Dias