Forsker Friedrich Kohlrausch (1840-1910) var den første som foreslo at rent vann leder elektrisitet, om enn i liten skala. Dette er fordi vann oppfører seg på en amfoter måte; det vil si at det ved visse anledninger fungerer som syre, som gir protoner (H+); og i andre oppfører den seg som en base, mottar protoner.
Dette betyr at vann utfører sin egen ionisering, i henhold til den kjemiske ligningen vist nedenfor:
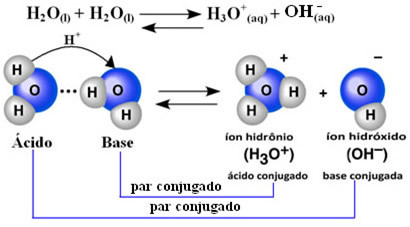
Denne prosessen kalles vann autoionisering og det forekommer i veldig liten skala, det vil si at vann er en veldig svak elektrolytt, med lave verdier av grad av ionisering og ioniseringskonstant i likevekt (Kç). Det er nettopp derfor vann har så lav ledningsevne.
For å få en ide er det ved en omgivelsestemperatur på 25 ° C mulig å bestemme at konsentrasjonene av hydroksid og hydroniumioner produsert ved selvionisering av rent vann er lik 1. 10-7 mol. L-1. Dette betyr at av to milliarder vannmolekyler bare to ioniserer.
Den ioniske balansekonstanten til vann kalles çvann dissosiasjon konstant,
autoprotolysekonstanteller ionisk produkt av vann.Denne konstanten er representert av Kw, fordi w refererer til ordet vann, som på engelsk betyr vann.Ikke stopp nå... Det er mer etter annonseringen;)
Dens beregning gjøres på samme måte som de andre likevektskonstantene, og husk at, som det står i teksten "Konstanter av Balanse Kc og Kp ”, i dette tilfellet vil bare produktene vises i uttrykket, fordi vann i flytende tilstand har samme aktivitet til 1. Rene flytende eller faste stoffer blir ikke satt i dissosiasjonens konstante uttrykk fordi de ikke forandrer seg. Bare vandige og gassformige oppløsninger plasseres. Så vi har:
Kw = [H3O+]. [Åh-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Som med de andre likevektskonstantene, OKw det endres bare med temperaturendringen. Når vanntemperaturen øker, øker også ioniseringen, noe som betyr at selvionisering av vann er en endoterm prosess, det vil si at den absorberer varme.
Dette kan sees i verdiene til det ioniske produktet av vann (Kw) gitt i tabellen nedenfor ved forskjellige temperaturer:
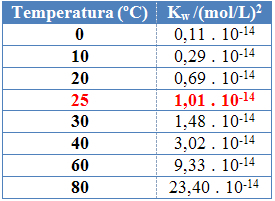
Det ioniske produktet av vann vil alltid ha en fast verdi ved hver temperatur, enten det er i rent vann eller i oppløsning. Selv om løsningen har konsentrasjoner av H-ioner3O+ og oh- forskjellig, vil produktet mellom dem forbli konstant.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Ionisk vannprodukt (Kw)"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm. Tilgang 28. juni 2021.



