I teksten "Konsentrasjon i mol / l eller molaritet”Du så at konsentrasjonen i mol / L er relatert til mengden materie i det oppløste stoffet (n1, målt i mol) med volumet av løsningen i liter (V). Imidlertid er det noen oppløste stoffer som, når de plasseres i vann, genererer ioner.
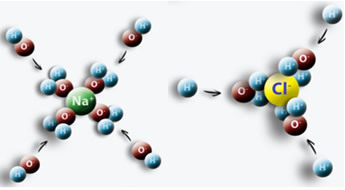
Et eksempel er når vi setter salt (NaCl) i vann, oppstår en tiltrekning mellom den positive polen i vannet med Cl og den negative polen med Na, noe som gir opphav til Na-ioner+ og Cl-.
Det er viktig å vite hvordan man bestemmer konsentrasjonen i mol / L av disse ionene, da dette kan være nyttig i mange situasjoner. Et område som bruker dette er medisin, spesielt i medisinske blodprøver. Blodet vårt og andre kroppsvæsker har ioner oppløst i seg. Hvis konsentrasjonen av disse ionene i blodet er over eller under det normale, kan det kompromittere kroppens rette funksjon og føre til lidelser og sykdommer.
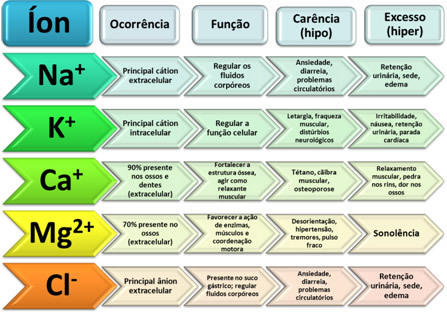
Se tilfelle av jernioner (Fe2+): hvis personen mangler dette ionet, kan han utvikle anemi. Når noen som har anemi får beskjed om at de trenger å spise jernrik mat eller til og med noe medisin som inneholder jern, er det faktisk jernionen og ikke det metalliske elementet.
Et annet tilfelle er når det er tap av kalsiumioner (Ca2+) i bein, forårsaker osteoporose, som vist på bildene med forstørrede bilder av bein nedenfor:

Se på andre eksempler på ioner som har viktige funksjoner i kroppen vår og må være i riktig konsentrasjon:

Derfor, gitt denne informasjonen, blir det tydelig at det å vite hvordan man skal beregne konsentrasjonen av ioner i løsninger er veldig viktig. Men hvordan kan dette gjøres?
Det er mulig å bestemme konsentrasjonene i mol / L av ionene som er tilstede i løsninger hvis det er kjent to viktige data, som er:
- Formlene for stoffer oppløst i vann;
- Molariteten til løsningene dine.
Med disse dataene i hånden, skriv dissosiasjonen eller ioniseringsligningen til det løste stoffet og finn ved å trekke ut konsentrasjonen av ionene, som den er proporsjonal med antall mol av hvert ion. Dette betyr at konsentrasjonen av ioner er proporsjonal med deres respektive koeffisienter i ioniserings- eller dissosiasjonsligningen.
Ikke stopp nå... Det er mer etter annonseringen;)
Se følgende eksempel for bedre å forstå hvordan denne beregningen utføres:
"Tenk på at konsentrasjonen i mengden materie av en gitt vandig løsning av magnesiumfosfat (Mg3(STØV4)2 er 0,5 mol / l. Hva vil være konsentrasjonen i mol / L av magnesiumkationer (Mg2+(her)) og fosfatanioner (PO3-4 (aq)) i denne løsningen, med tanke på at graden av dissosiasjon (α) var 100%? "
Det første trinnet i å løse dette problemet er å skrive dissosiasjon eller ioniseringsligning. Hvis du har problemer, kan du basere deg på den generiske ligningen nedenfor:
1 AxBy → x A+ y + y B-x
1 mol x mol y mol
Så vurderer vi i dette eksemplet at magnesiumfosfat er fullstendig dissosiert, har vi følgende ligning:
1 mg3(STØV4)2 (aq) → 3 mg2+(her) + 2 gp3-4 (aq)
1 mol 3 mol 2 mol
Vi kan se at 1 mol Mg3(STØV4)2 gir 3 mol Mg2+(her) og 2 mol PO3-4 (aq); således vil antall mol av kationen være 3 ganger antallet mol av fosfatet som løsningen ble fremstilt med, og det av anionene vil være 2 ganger.
Siden løsningen er 0,5 mol / l Mg3(STØV4)2 (aq) , dette betyr at 0,5 mol Mg ble oppløst i 1 liter av det3(STØV4)2, som ga 1,5 mol / l Mg2+(her) og 1,0 mol / l PO3-4 (aq):
1 mg3(STØV4)2 (aq) → 3 mg2+(her) + 2 gp3-4 (aq)
1 mol 3 mol 2 mol
0,5 mol x y
1. 0,5 3. 0,5 2. 0,5
0,5 mol / l 1,5 mol / l1,0 mol / l
Men hva om graden av dissosiasjon eller ionisering ikke var 100%? La oss si at det var 70%, hvordan skulle vi gå frem for å finne ut mol / L-konsentrasjonen av disse ionene?
I så fall er det bare å utføre en enkel regel på tre. Se nedenfor:
1,5 mol / l Mg2+(her) 100 %
x 70%
x = 70. 1,5 → x = 1,05 mol / L Mg-ioner2+(her)
100
1,5 mol / l PO3-4 (aq) 100 %
y 70%
y = 70. 1,0 → y = 0,70 mol / L PO-ioner3-4 (aq)
100
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Ionkonsentrasjon i mol / l"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/concentracao-dos-ions-mol-l.htm. Tilgang 28. juni 2021.
Kjemi

Dissosiasjon og ionisering, italiensk forsker Volta, elektrisk strøm, svensk fysisk kjemiker Svant August Arrhenius, teorien om Arrhenius, positive ioner, kationer, negative ioner, anioner, kaustisk brus, bordsalt, polære molekyler, dissosiasjon ionisk,