O beregning av atommasse av et element er den matematiske ressursen som brukes til å bestemme masseverdien som er tilstede i det periodiske systemet for hvert av de eksisterende kjemiske elementene. Generelt å utføre atommasseberegning, må vi vite følgende variabler av kjemisk element:
Elementisotoper;
Massetall for hver isotop av elementet;
Prosentandelen av hver isotop av elementet i naturen.
Beregningen av atommassen til hydrogen ble for eksempel utført basert på følgende data:
Presenterer protiumisotoper (H1), deuterium (H2) og tritium (H3);
Massene av disse isotopene er henholdsvis 1, 2 og 3;
Prosentandelen av Protium i naturen er 98,9%;
Prosentandelen av deuterium i naturen er 0,09%;
Prosentandelen av tritium i naturen er 0,01%.
Matematisk standard for beregning av atommasse
Å gjennomføre atommasseberegning av ethvert kjemisk element, må vi bruke følgende matematiske mønster:
1O: multipliser massetallet på hver isotop med prosentandelen;
2O: legg til alle resultatene som ble funnet i multiplikasjonene i første trinn;
3O: del den funnet summen med 100.
M.A. = massenummer.prosent + massenummer.prosent
100
Mind Map: Atomic Mass
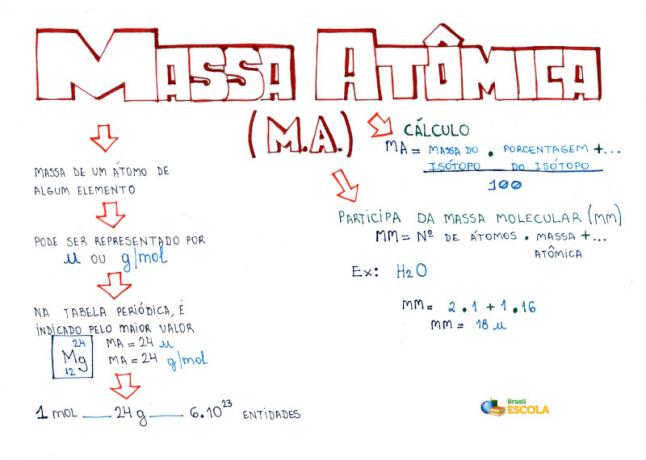
* For å laste ned tankekartet i PDF, Klikk her!
Eksempler på atommasseberegning
⇒ Første eksempel: Beregning av atommassen til svovel.
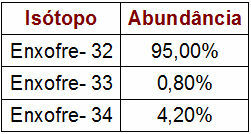
Prosentandel og massedata for svovelisotoper
Tabellen angitt angir massetall og prosentandel av hver svovelisotop i naturen. For å utføre atommasseberegningen, utfør bare følgende trinn:
1O Steg: multipliser massetallet på hver isotop med verdien av overflod.
Svovel - 32 (S32)
s32 = 32.95
s32 = 3040
Svovel - 33 (S33)
s33 = 33.0,8
s33 = 26,4
Svovel - 34 (S34)
s34 = 34.4,2
s34 = 142,8
2O Steg: legg til verdiene som er funnet i multiplikasjonene av massetallet og isotopens overflod.
Sum = S32 + S33 + S34
Sum = 3040 + 26,4 + 142,8
Sum = 3209,2
3O Steg: beregne atommassen ved å dele summen av resultatene funnet med 100:
M.A. = Sum
100
M.A. = 3209,2
100
M.A. = 32,092 u
⇒ 2. eksempel: Et gitt kjemisk element (D) har tre isotoper, hvis massetall er:
30D 32D 34D
Å vite at atommassen til dette elementet er 32,20 u og at det er 20% av isotopen 32D i naturen, hva er verdien av prosentandelen av de andre isotoper?
Uttalelsen gir massetallene, atommassen og prosentandelen av en av isotopene. For å bestemme prosentandelen av andre isotoper, må vi utføre følgende trinn:
1O Steg: bestem prosentandelen av hver isotop.
Isotop - 30 (DS30)
DS30 = 30.x
DS30 = 30x
Isotop - 32 (DS32)
DS32 = 32.20
DS32 = 640
Isotop - 34 (D34)
DS34 = 34.y
DS34 = 34 år
2O Steg: bruk alle dataene som er funnet i det matematiske uttrykket for å beregne atommassen.
M.A. = massenummer.prosent + massenummer.prosent
100
32,2 = 30x + 640 + 34y
100
32,2.100 = 30x + 640 + 34y
100
3220 - 640 = 30x + 34y
30x + 34y = 2580
x = 2580 - 34 år
30
3O Steg: bruk uttrykket som er funnet ovenfor fra følgende resonnement:
Prosent av isotop 1 + Prosent av isotop 2 + Prosent av isotop 3 = 100%
x + 20 + y = 100
x + y = 100 - 20
x + y = 80
x = 80 - y
2580 - 34 år = 80-y
30
2580 - 34 år = 30. (80-y)
2580- 34 år = 2400 - 30 år
2580 - 2400 = 34 år-30 år
4y = 180
y = 80
4
y = 45%
4O Steg: beregne prosentverdien av x i uttrykket konstruert i tredje trinn.
x + y = 80
x + 45 = 80
x = 80 - 45
x = 35%
Av meg. Diogo Lopes Dias
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/calculo-massa-atomica.htm

