Dispersjoner refererer til blandinger generelt. For eksempel når vi blander salt med vann eller salt og sand får vi to dispersjoner. Et stoff som spres homogent (som salt i vann) eller heterogent (som sand i vann), kalles “spredt”. Vann, derimot, fungerer som et dispergeringsmiddel i disse tilfellene.
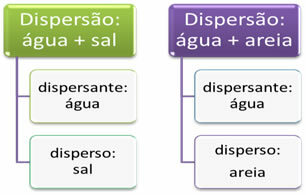
Hovedforskjellen mellom disse to dispersjonene er i dispersjonspartikkelstørrelsen. Mens sandkornene kan sees med det blotte øye, er saltpartiklene usynlige. Basert på dette kan dispersjoner klassifiseres i tre hovedtyper, som er:
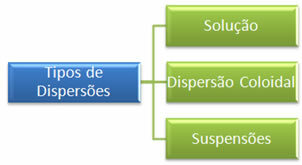
Merk, i tabellen nedenfor, forskjellen i størrelsen på de spredte partiklene:

* Løsninger: de er homogene blandinger der vi ikke kan se de spredte partiklene selv under et mikroskop. Noen eksempler er det nevnte saltet blandet med vann og også sukker blandet med vann.
Når det gjelder løsninger, kalles dispersjonen løsemiddel og dispergeringsmidlet kalles løsningsmiddel. Løsninger kan ikke skilles fra ved noen filtreringsprosesser.
* Kolloidal eller kolloid dispersjon:
noen eksempler er majones og gelatin. Partiklene blir ikke visualisert med det blotte øye, så de forveksles ofte med homogene systemer, men de er faktisk heterogene, slik man kan se ved bruk av mikroskop. Partiklene avgjør ikke med tyngdekraften, men bare med ultrasentrifuger.Ikke stopp nå... Det er mer etter annonseringen;)
Det er flere typer kolloidale dispersjoner, som er: sol, fast sol, gel, emulsjon, skum og aerosol.
Å skille denne typen spredning er ikke mulig med filtrering, men med en semipermeabel membran. Partiklene reflekterer og sprer lys.
* Suspensjoner: de er heterogene systemer der det, selv med det blotte øye, er mulig å visualisere partiklene deres. Noen eksempler er: sand i vann, leire i vann, melk av magnesia og kalamin.
I tilfelle spredning reflekteres også lys. Og separasjonen kan gjøres ved vanlig filtrering.

* Selv om noen forfattere og forskere har foreslått at kolloidale partikler har en størrelse mellom 1 og 100 nm, og at suspensjoner er større enn 100 nm, har eksperimentell bevis en tendens til å øke denne verdien til 1000 nm, og denne verdien er den mest aksepterte av de fleste forfattere. Imidlertid vil dens makroskopiske oppførsel virkelig avgjøre om blandingen er kolloidal eller en suspensjon.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Typer av dispersjoner"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/tipos-dispersoes.htm. Tilgang 28. juni 2021.


