Ifølge den franske kjemikeren Henry Louis Le Chatelier, likevektsskifte det er en situasjon der en kjemisk reaksjon forskyves (forover eller bakover) når den utsettes for en ekstern forstyrrelse. Denne uttalelsen foreslått av kjemikeren ble kjent som prinsippet til Le Chatelier.
Merk: direkte reaksjon er den der reaktantene blir transformert til produkter, mens den omvendte reaksjonen er den der produktene transformeres til reaktanter.
En reaksjon er i likevekt når hastigheten til den direkte reaksjonen er den samme som omvendt reaksjon, det vil si reaktanter blir til produkter i samme hastighet som produkter blir reaktanter.

Generell fremstilling av en kjemisk likevektsreaksjon
I henhold til Le Chateliers prinsipp, når en styrke virker på en likevektsreaksjon, vil likevektsskifte det vil finne sted for å oppheve denne forstyrrelsen og etablere en ny likevektssituasjon i reaksjonen.
Forstyrrelsene i stand til forskyve en kjemisk balanse de er:
→ konsentrasjonsvariasjon
når konsentrasjon i mengde materie
(i mol / l eller molar) av en deltaker i reaksjonen endres (enten redusert eller økt), balanseforskyvning, så lenge den deltageren ikke er i solid tilstand.I henhold til Le Chateliers prinsipp, hvis konsentrasjon hvis en deltaker økes, vil balansen skifte i motsatt retning av økningen. Imidlertid, hvis konsentrasjon deltakeren er redusert, vil det være en forskyvning av balansen i retning av nedgangen. For eksempel:

Generell fremstilling av en kjemisk likevektsreaksjon
Å øke konsentrasjonen av A = balanse skifter til høyre
Å redusere konsentrasjonen av B = balansen skifter til venstre
→ Variasjon av press
Trykkvariasjonen fremmer bare forskyvning i likevekt som har gasskomponenter, siden når det økes, øker molekylene kollisjonene med hverandre, og når trykket reduseres, reduserer de kollisjonene med hverandre.
Kollisjonene mellom molekyler øker med økende press, fordi volumet (mellomrom) reduseres tilsvarende, mens det reduseres press er ledsaget av økende volum.
Ikke stopp nå... Det er mer etter annonseringen;)
Merk: I en kjemisk likevekt tar analysen av effekten av trykkmodifisering hensyn til molarvolumet av reaktanter og produkter, hvilket volum er relatert til reaksjonskoeffisientene. I ligningen nedenfor er reagensvolumet 4 og produktet er 2.
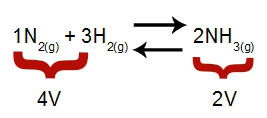
Ligning som indikerer volumene som er tilstede i dannelsen av ammoniakk
I følge Le Chateliers prinsipp, hvis trykket i et system økes, vil forskyvningen av balanse i retning av større volum, mens hvis trykket reduseres, vil forskyvningen av balansere.

Ligning som representerer balansen mellom dannelse av ammoniakk
Økende trykk = balanse skifter til høyre (fordi det er siden med mindre volum).
Avtagende trykk = balanse skifter til venstre (fordi dette er siden med høyere volum).
→ Temperaturvariasjon
Økningen i temperatur av en likevektsreaksjon favoriserer molekylene til å kollidere mer, mens reduksjonen av temperatura reduserer uro og følgelig sjokk. Siden temperaturøkningen alltid favoriserer en reaksjon endotermisk (en som absorberer energi).
Analysen av effekten av temperatur på en likevekt tar hovedsakelig hensyn til reaksjonens ΔH. Hvis ΔH er positiv, vil fremoverreaksjonen være endoterm, mens motsatt vil være eksoterm. Hvis ΔH er negativ, vil den rette være eksoterm og den omvendte, endoterm.
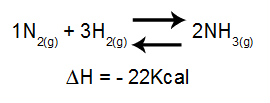
Ligning som inneholder entalpi-variasjon i ammoniakkdannelse
Økende temperatur = likevekt skifter mot venstre (fordi dette er retningen for den endotermiske reaksjonen, siden Ah er negativ).
Fallende temperatur = likevekt skifter mot høyre (fordi dette er retningen til den eksoterme reaksjonen, siden ΔH er negativ).
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Hva er likevektsforskyvning?"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-deslocamento-equilibrio.htm. Tilgang 28. juni 2021.
