Dynamisch evenwicht of chemisch evenwicht van een reactie treedt op wanneer de voorwaartse en omgekeerde reacties gelijktijdig plaatsvinden. Deze zogenaamde omkeerbare systemen worden weergegeven door pijlen in beide richtingen:  of
of  . Een voorbeeld van een omkeerbare reactie wordt genoemd in de afbeelding hierboven, tussen jodiumgas en waterstofgas.
. Een voorbeeld van een omkeerbare reactie wordt genoemd in de afbeelding hierboven, tussen jodiumgas en waterstofgas.
Aan het begin van de reactie is de hoeveelheid reactanten maximaal en die van producten nul. De reactanten reageren echter met elkaar, waardoor hun concentratie afneemt en die van de gevormde producten toeneemt. De ontwikkelingssnelheid van de directe reactie neemt ook af.
Naarmate de concentratie van de producten toeneemt, begint de omgekeerde reactie en worden de reactanten opnieuw gevormd; de ontwikkelingssnelheid van de inverse reactie neemt ook toe.
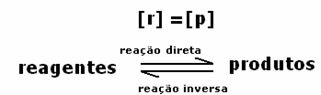
Bij het bereiken van chemisch evenwicht, bij constante temperatuur, zijn de ontwikkelingssnelheden van de voorwaartse en achterwaartse reacties gelijk.
Alledirect = Alles inverse
De tarieven zijn hetzelfde, maar de concentraties niet. Het is onwaarschijnlijk dat de concentraties van reagentia en producten hetzelfde zijn. Slechts in zeldzame gevallen komt dit voor. In de meeste gevallen zal de concentratie van reagentia hoger zijn dan die van producten of omgekeerd.
We hebben dus drie mogelijke manieren om de ontwikkelingssnelheden van grafisch weer te geven directe en inverse reacties, waarbij de concentraties van reactanten en producten over de tijd. Laten we naar elk geval kijken:
1e geval: Gelijke concentraties:
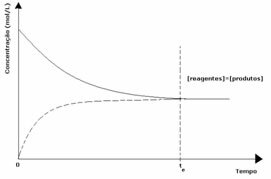
Zoals te zien is in de grafiek, op tijdstip ten de voorwaartse en achterwaartse reacties zijn hetzelfde, in welk geval de concentraties van reactanten en producten hetzelfde zijn. De balans wordt dus niet naar beide kanten verschoven, de intensiteit van beide reacties is hetzelfde, zoals hieronder weergegeven:
Niet stoppen nu... Er is meer na de reclame ;)
2e geval: Concentratie van reagentia groter dan concentratie van producten:
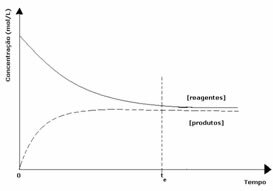
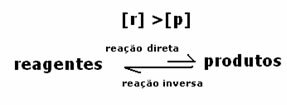
In dit geval wordt waargenomen dat bij het bereiken van evenwicht de concentratie van reactanten groter is dan die van de producten. Er wordt dus geconcludeerd dat als er meer reactant is, de omgekeerde reactie met grotere intensiteit plaatsvindt. De reactie wordt naar links verschoven:
3e geval: Concentratie van producten groter dan die van reagentia:
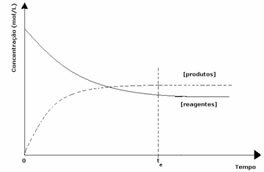
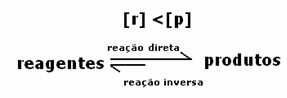
Aangezien bij evenwicht de concentratie van producten groter is, betekent dit dat de reactie is naar rechts verschoven, omdat de directe reactie (met vorming van producten) met grotere intensiteit.
Wat zal aangeven of de reactie naar rechts of naar links neigt, is de evenwichtsconstante K, die alleen afhangt van de temperatuur.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Brazilië School Team
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Grafische studie van chemisch evenwicht"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm. Betreden op 28 juni 2021.
Chemie

Test je kennis en leer meer met deze lijst met opgeloste oefeningen over chemische balansen. Door dit materiaal zul je beter kunnen begrijpen hoe je evenwichtsconstanten (Kp, Kc en Ki), evenwichtsverschuiving, pH en pOH, evenals evenwicht in zogenaamde bufferoplossingen kunt bewerken.