Middelbare scholieren worden altijd geconfronteerd met redoxreacties met ionen, zowel bij toelatingsexamens als bij het Nationaal High School Examination (Enem). Het balanceren van deze vergelijkingen kan dus een veel gevreesd onderwerp zijn.
Om het begrip van dit onderwerp te vergemakkelijken, probeert deze tekst de balanceren van redoxvergelijkingen met ionen met de beschrijving van enkele stappen om het uit te voeren. Hiervoor moeten we beginnen met het identificeren van dit type chemische reactie.
Bij redoxreacties met ionen worden geïdentificeerd door de aanwezigheid van een of meer componenten met ladingen (positief of negatief), dat wil zeggen de ionen (kationen of anionen), die aanwezig kunnen zijn in reagentia of producten, zoals in de twee voorbeelden a volgen:
1e voorbeeld:Cr2O72- + Fe2+ + H+ → Cr3+ + Fe3+ + H2O
2e voorbeeld:kl2 + C + H2O → CO2 + H+ + Cl-
Het uitvoeren van de balancerende vergelijkingen van redoxreacties met ionen, het is essentieel om enkele stappen te volgen, zoals:
1e stap: bepaal de NOX van elk van de atomen van de reactanten en producten van de vergelijking;
2e stap: controleer welke soort heeft geleden oxidatie;
3e Stap: bepaal de variatie van de NOX de soort die oxidatie heeft ondergaan;
4e Stap: vermenigvuldig de variatie gevonden in de derde stap met het aantal atomen van de oxiderende soort;
5e stap: controleer welke soort heeft geleden vermindering;
6e Stap: bepaal de NOX-variatie van de soorten die reductie hebben ondergaan;
7e Stap: vermenigvuldig de variatie gevonden in de derde stap met het aantal atomen van de soort die het vermindert;
8e stap: gebruik de waarde gevonden in de vierde stap als de coëfficiënt van de soort die vermindert;
9e stap: gebruik de waarde gevonden in de zevende stap als de coëfficiënt van de oxiderende soort;
10e Stap: zet de coëfficiënten in de andere soorten, volgens de methode van proef balanceren. In die soorten waar dit niet mogelijk is, zet u onbekenden als coëfficiënten;
11e Stap: vermenigvuldig de coëfficiënt van elke soort met zijn belasting;
12e stap: egaliseer de som van de ladingen van reactanten met die van producten om de coëfficiënt van een van de soorten met onbekenden te vinden;
13e Stap: voltooi de balans met behulp van de proefmethode.
Om het begrip te vergemakkelijken, volgt u de hierboven beschreven stap-voor-stap, in het volgende voorbeeld van a redoxvergelijking met ionen:

Ionische vergelijking met enkele ionen en algemene ladingsgroepen 0
1e stap: NOX van elk atoom.

NOX van atomen aanwezig in de vergelijking
2e stap: Soorten die oxidatie ondergaan.

Soorten die oxidatie ondergaan in de vergelijking
Aangezien de NOX van jodium stijgt van -1 naar 0 van reactant tot product, is het daarom de soort die oxidatie ondergaat.
3e stap: Bepaal de NOX-variatie van de geoxideerde soorten.
Om dit te doen, trekt u gewoon de hoogste NOX af van de laagste NOX:
∆NOX = (0) – (-1)
∆ NOX = 0 + 1
∆ NOX = 1
Stap 4: Vermenigvuldiging van NOX met hoeveelheid.
In deze stap vermenigvuldigen we de variatie gevonden in de derde stap met het aantal atomen van de soort.
ik- = ∆NOX.1
ik- = 1.1
ik- = 1
5e stap: Soorten die reductie ondergaan.

Soorten die te lijden hebben onder reductie in de vergelijking
Aangezien chroom-NOX van +7 naar +3 van reactant tot product afneemt, is het daarom de soort die de reductie ondergaat.
6e stap: Bepaal de NOX-variatie van de gereduceerde soort.
Om dit te doen, trekt u gewoon de hoogste NOX af van de laagste NOX:
∆NOX = (+6) – (+3)
∆ NOX = +6 – 3
∆ NOX = 3
7e stap: Vermenigvuldiging van NOX met hoeveelheid.
In deze stap vermenigvuldigen we de gevonden variatie in de zesde stap met het aantal atomen van de soort.
Cr2O72- = ∆NOX.1
Cr2O72- = 3.2
Cr2O72- = 6
8e stap: Begin met balanceren.
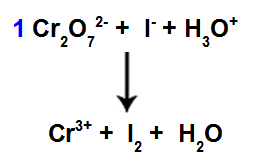
Begin van balanceren met behulp van gevonden coëfficiënt
In deze stap beginnen we met het balanceren door de coëfficiënt gevonden in de vierde stap te plaatsen in de soort die onder reductie heeft geleden.
9e stap: Ga door met balanceren.

Voortzetting van het balanceren met behulp van de gevonden coëfficiënt
10e stap: Gebruik de proefmethode.
Er zijn 6 I-atomen in de reactant, dus we moeten de coëfficiënt 3 in de I-soort zetten2 van het product, omdat er maar 2 Cl-atomen in zitten;
Zoals bij soort 1, Cr2O72-, er zijn 2 Cr-atomen, we moeten de coëfficiënt 2 in de Cr-soort zetten3+ van product.
Omdat we zuurstof hebben in drie soorten, en in twee daarvan zijn er geen coëfficiënten, om de balans voort te zetten, moeten we onbekenden plaatsen in de overige soorten:
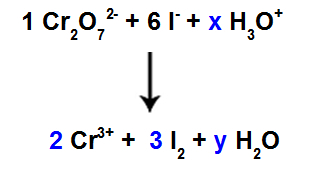
Coëfficiënten na gebruik van de proefmethode
11e stap: Vermenigvuldiging van elke soort door zijn lading.
Om dit te doen, vermenigvuldigt u gewoon de coëfficiënt van de soort met zijn belasting, als volgt:
In de reagentia:
Cr2O72- = 1.(-2) = -2
ik- = 6.(-1) = -6
H3O+ = x.(+1) = +x
Op de producten:
Cr3+ = 2.(+3) = +6
ik2 = 4.0 = 0
H2O = y.0 = 0
12e stap: Som van kosten.
In deze stap moeten we de ladingen reagentia en producten toevoegen die in stap 11 zijn gevonden:
Reagentia = producten
-2 + (-8) + (+x) = +6 + 0 + 0
-2 - 6 + x = 6
-8 + x = 6
x = 6 + 8
x = 14
13e stap: Einde van het balanceren.
Om het balanceren te voltooien, moeten we:
Zet het gevonden resultaat in de 12e stap in soort H3O+;
Omdat we nu 42 H-atomen in het reagens hebben, is het noodzakelijk om de coëfficiënt 21 in de H-soort te plaatsen2De in het product.
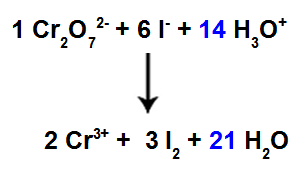
Evenwichtige ionische reactievergelijking
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-com-ions.htm