DE sp-type koolstofhybridisatie het gebeurt alleen wanneer het twee pi-bindingen (π) en twee sigma-bindingen (σ) maakt. In dit geval zijn er dus twee mogelijkheden: koolstof kan twee dubbele bindingen maken of een enkele en een drievoudige binding, zoals hieronder weergegeven:
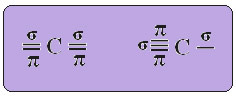
De tekst "sp type hybridisatie3” laat in detail zien hoe koolstofhybridisatie plaatsvindt. Onthoud: hybridisatie is het "vermengen" van zuivere atomaire orbitalen, die hybride atomaire orbitalen voortbrengen die gelijkwaardig zijn aan elkaar, maar verschillen van de oorspronkelijke zuivere orbitalen. Dit gebeurt dus in de koolstoforbitalen die oorspronkelijk als volgt werden weergegeven:
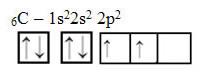
Met de ontvangst van energie wordt echter een elektron (weergegeven door een pijl) van de 2s-orbitaal gepromoveerd tot de 2p-orbitaal:
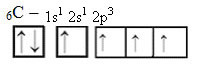
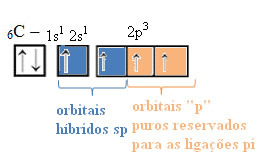
Op deze manier heeft de koolstof vier ongepaarde orbitalen, die vier covalente bindingen kunnen maken, niet slechts twee.
In het geval van sp-type hybridisatie weten we dat twee bindingen pi zullen zijn; deze komen voor in de zuivere "p"-orbitalen, terwijl de andere twee orbitalen, die sp-hybriden zijn, de resterende sigma-bindingen zullen maken.
De ruimtelijke weergave van deze hybridisatie tussen een s- en een p-orbitaal, die aanleiding geeft tot een hybride sp-orbitaal, kan als volgt worden weergegeven:
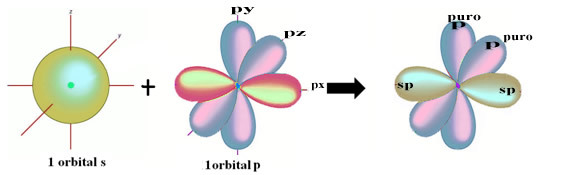
In de bovenstaande figuur is het heel duidelijk dat er twee zuivere orbitalen zijn die de pi-bindingen zullen maken.
Laten we, om te begrijpen hoe dit gebeurt, als voorbeeld een molecuul cyanidegas (HCN) nemen, dat in de Verenigde Staten wordt gebruikt in gaskamers voor gevangenen die tot de doodstraf zijn veroordeeld. De structuurformule wordt gegeven door:
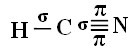
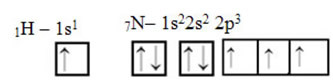
Wat koolstof betreft, zijn atomaire orbitalen al getoond, kijk nu naar de waterstof- en stikstoforbitalen:
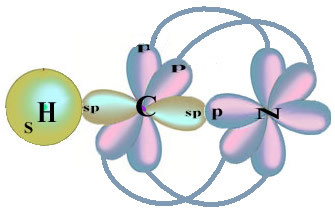
Merk op dat de ongepaarde waterstoforbitaal die de sigma-binding zal uitvoeren de "s" is, die ruimtelijk wordt weergegeven door een cirkel; en stikstoforbitalen zijn van het "p" -type, weergegeven door drie dubbele eivormig (elk in een ruimtelijk veld: x, y, z). De structuur van het HCN-molecuul wordt dus als volgt weergegeven:
Wat betreft het type bindingen dat in deze formaldehydestructuur bestaat, hebben we:
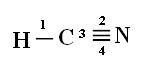
Verbindingen: 1 = σs-sp
2 = σp-sp
3 = 4 = πp-p
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm

