De elektronische verdeling van de elektronen van een atoom in de neutrale of fundamentele toestand wordt gewoonlijk uitgevoerd met de Pauling-diagram, hieronder weergegeven:
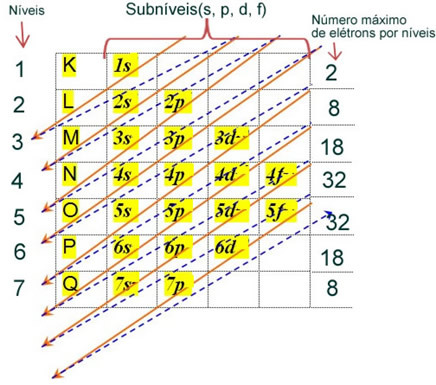
De gedetailleerde regels van deze distributie zijn te vinden in de volgende twee teksten op onze website: “Elektronische distributie van elektronen" en "Regels voor elektronische distributie”.
De elektronische verdeling van ionen werkt aanvankelijk op dezelfde manier als voor atomen in de neutrale toestand; met slechts één verschil. Aangezien een ion een atoom is dat elektronen heeft gewonnen of verloren, moeten we hier rekening mee houden en het volgende doen:

Een belangrijke observatie is: de verandering wordt gemaakt op het buitenste subniveau en niet op het meest energieke.
als het ion een is kation, wij moeten verwijder de elektronen dat hij verloor. Laten we een voorbeeld bekijken:
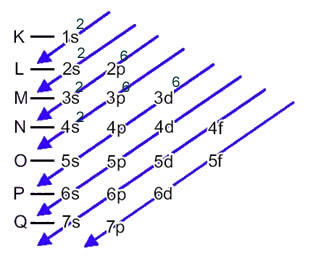
Het ijzeratoom (atoomnummer = 26) heeft de volgende elektronische verdeling in de subniveaus in energetische volgorde: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Wat de elektronische lagen betreft, hebben we: K =2; L = 8; M = 14; N = 2.
Deze verdeling wordt weergegeven in het onderstaande Pauling-diagram:
Wanneer het ijzeratoom 2 elektronen verliest, verandert het in het Fe-kation.2+. Dus bij het maken van uw elektronische distributie moeten we: verwijder 2 elektronen uit de laatste schil(N) en niet het meest energetische subniveau, zoals hieronder weergegeven:
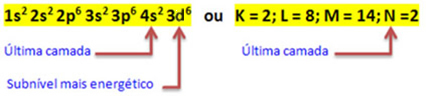
Dus de elektronische distributie van het Fe-kation2+ is gegeven door:
1s2 2s2 2p6 3s2 3p6 3d6 of K = 2; L = 8; M = 14
Als we nu de elektronische distributie van a anion, wij moeten voeg de elektronen toe die het heeft ontvangen.Bekijk in het volgende voorbeeld hoe dit wordt gedaan:
Het zwavelanion (16zo2-) wordt gevormd uit het zwavelatoom (16S) door de versterking van 2 elektronen, zoals aangegeven door lading 2-. De elektronische distributie van de grondtoestand wordt gegeven door:
1s2 2s2 2p6 3s2 3p4 of K = 2; L = 8; M = 6
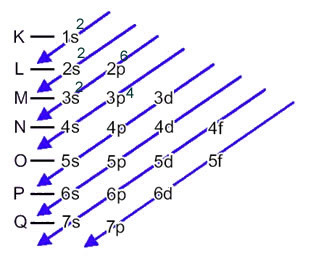
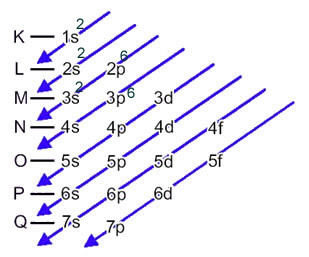
In dit geval is het laatste subniveau hetzelfde als het energiesubniveau, 3p. Dus voegen we er de twee elektronen van het zwavelanion aan toe:
1s2 2s2 2p6 3s2 3p6 of K = 2; L = 8; M = 8
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/distribuicao-eletronica-ions.htm
