Ionisatie is een chemische reactie waarbij ionen ontstaan uit moleculaire stoffen die in water zijn geplaatst.
We kunnen dus zeggen dat ionisatie de proces vanionenvorming.
Zuren zijn voorbeelden van stoffen die ionisatie ondergaan wanneer ze in water worden geplaatst.
ionisatieproces
Bekijk hoe het ionisatieproces plaatsvindt aan de hand van het volgende voorbeeld:
Wanneer het in water wordt geplaatst, ondergaat zoutzuur (HCl) ionisatie. De chemische binding tussen H en Cl wordt verbroken en er worden H-ionen gevormd+ en Cl-, die worden omgeven door water.
Zoals we hebben gezien, is de H+ verloor een elektron en de Cl- een elektron gekregen. Echter, de H+ het moet stabiliseren en dus bindt het zich aan water.
De HCl-ionisatiereactie kan dus ook als volgt worden weergegeven:
Nu observeren we de vorming van het hydroniumkation (H3O+), resultaat van de vereniging van de H+ en van H2O.
Het is ook belangrijk op te merken dat in dit voorbeeld Cl het elektron ontvangt omdat dit het meest is elektronegatief
, dat wil zeggen, het heeft de neiging om elektronen op te nemen. Daarom trok het gemakkelijk de elektronen naar zich toe.Lees ook:
- elektronen
- ion, kation en anion
- Chemische reactie
Bekijk andere ionisatievoorbeelden:
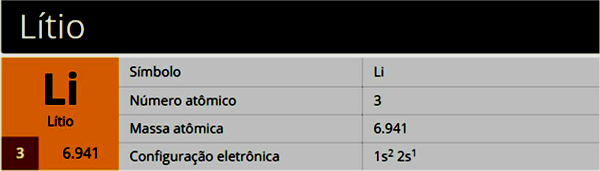
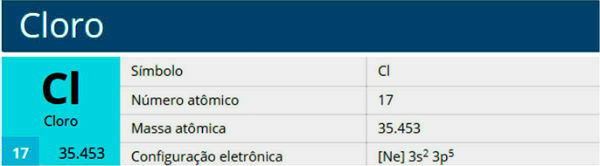
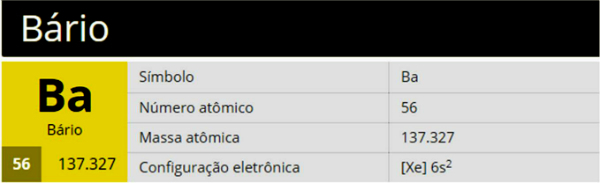
1)
2)
DE ionisatieenergie of ionisatiepotentiaal is een periodieke eigenschap die de hoeveelheid energie aangeeft die nodig is om een elektron van een atoom in een grondtoestand over te brengen.
Dissociatie en ionisatie
DE dissociatie het is een natuurkundig fenomeen, geen chemische reactie. Het verwijst naar het vrijkomen van bestaande ionen uit ionische verbindingen in water.
Het belangrijkste verschil tussen dissociatie en ionisatie is:
- Ionisatie: ionen worden gevormd;
- Dissociatie: bestaande ionen scheiden.
Het dissociatieproces vindt alleen plaats met zouten en basen. Voorbeeld: NaCl, keukenzout.
Dissociatie en ionisatie zijn belangrijke processen om chemische reacties te laten plaatsvinden, aangezien vrije ionen reactiever zijn dan moleculen.
Lees ook:
- zuren
- zouten
- basissen
- ionische balans
- Concept en bepaling van pH en pOH
- Neutralisatie-reactie
Zorg ervoor dat u toelatingsexamenvragen over het onderwerp, met een becommentarieerde resolutie, bekijkt in: oefeningen op anorganische functies.