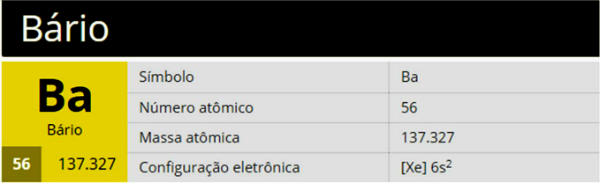
Barium is een chemisch element met het symbool Ba, atoomnummer 56 en atoommassa 137.327, behorend tot groep 2 (Familie 2A) van het periodiek systeem, zijnde een aardalkalimetaal.
De naam is afgeleid van het Grieks barys en het betekent zwaar.
Kenmerken
Bij kamertemperatuur wordt het gevonden in een vaste toestand, met een zachte consistentie en een zilverachtige kleur. In de natuur wordt het echter niet in zijn pure vorm gevonden, omdat het gemakkelijk wordt geoxideerd in contact met lucht.
Barium wordt gevonden in barietertsen (BaSO4) en verdorren (BaCO3). De belangrijkste mijngebieden voor deze ertsen bevinden zich in het VK, Italië, Tsjechië, de VS en Duitsland.
Barium heeft hoge smeltpunten (1000 K - 727 °C) en kookt (2170 K - 1897 °C). Het is nog steeds een goede geleider van elektriciteit.
Het is zeer reactief in contact met water en alcohol. De reactie met water produceert hydroxide en releases waterstof.
Oplosbare bariumverbindingen zijn giftig voor het lichaam. Ondanks dat het wordt aangetroffen in water en voedsel, is de aanwezige hoeveelheid barium niet voldoende om gezondheidsproblemen te veroorzaken.
Vanwege het hoge oxiderende vermogen moet barium worden bewaard in minerale olie.
Lees meer, lees ook:
- Chemische elementen
- Periodiek systeem
toepassingen
Tot de belangrijkste toepassingen van barium behoren:
- In zijn pure vorm wordt het gebruikt voor het verwijderen van zuurstof uit elektronische kleppen;
- Rattengif, in de vorm van bariumcarbonaat;
- Gebruikt als wit pigment in verven;
- Glas productie;
- Bariumsulfaat wordt gebruikt als vloeistof voor het boren van olie- en gasbronnen;
- Bariumchloraat en nitraat worden gebruikt bij de productie van groene vlammen in pyrotechnische fakkels;
- Bariumsulfide verbetert het contrast voor röntgenonderzoeken van het spijsverteringsstelsel en wordt oraal aan patiënten toegediend. Inslikken veroorzaakt geen gezondheidsproblemen, omdat de stof onoplosbaar is, zich niet ophoopt en snel uit het lichaam wordt geëlimineerd;
Hoewel bariumsulfide onschadelijk is, is bariumcarbonaat uiterst giftig en kan het dodelijk zijn. De persoon met intoxicatie heeft ademhalingsmoeilijkheden, braken, tremoren, tachycardie, verhoogde bloeddruk en speekselvloed.
Mogelijk bent u ook geïnteresseerd in:
- Metalen schakels
- Koper
- Lithium