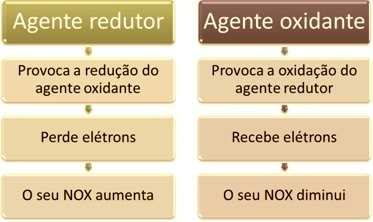
Een van de belangrijkste kenmerken die een oxidatie-reductiereactie (of redox) van de andere is de aanwezigheid van een oxidatiemiddel en een reductiemiddel, die als volgt kan worden gedefinieerd:
Kijk bijvoorbeeld naar de chemische reactie hieronder waarbij aluminium (Al) corrodeert in een waterige zoutzuur (HCl) oplossing. Aluminiumatomen dragen elektronen over aan H-kationen+(hier) en produceer het Al-kation3+(hier):
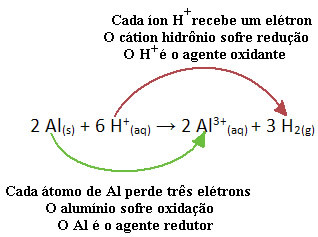
Merk op dat aangezien Al elektronen heeft overgedragen, dit betekent dat: hij veroorzaakte de reductie van de H-kationen+(hier); daarom heet hij reductiemiddel. Al het kation H+(hier) de elektronen uit het aluminium verwijderd, oxidatie veroorzaken van dat metaal; daarom handelt hij als een oxidatiemiddel:.
In het dagelijks leven zijn er veel voorbeelden van de prestaties van oxidatiemiddelen en reductiemiddelen. Bekijk er enkele en onthoud echter dat de reductie in alle gevallen gelijktijdig met de oxidatie plaatsvindt; daarom, als er een reductiemiddel is, is er ook een oxidatiemiddel.
- Voorbeelden van reductiemiddelen:
- In fotografische films: fotografische films bevatten lichtgevoelige zilverzouten. Op punten waar er licht is, is er een reductie van Ag-ionen+, wat resulteert in het contrast waargenomen in de negatieven.

- Vitamine C: Vitamine C (L-ascorbinezuur) is een krachtig reductiemiddel in waterige oplossing. Het heeft een uitzonderlijke mogelijkheid om te worden geoxideerd en daarom wordt het veel gebruikt, vooral in voedingsmiddelen zoals a antioxidant, dat wil zeggen, het wordt toegevoegd aan andere voedingsmiddelen en beschermt ze tegen mogelijke oxidatie, vanwege zijn eigen offer. Een voorbeeld is fruit zoals appels en peren die donker worden in contact met zuurstof in de lucht, omdat ze oxideren. Maar als je een kleine hoeveelheid sinaasappel- of citroensap (die vitamine C bevat) aan het fruit toevoegt knippen, voorkomt dit dat deze reactie optreedt, omdat vitamine C als reductiemiddel werkt en vóór het fruit oxideert.

- Hydrogen gas: het waterstofgas (H2) wordt gebruikt bij de voortstuwing van raketten en wordt beschouwd als een van de belangrijkste energiealternatieven, omdat bij de verbranding een grote hoeveelheid energie vrijkomt en geen verontreinigende stoffen. In deze reactie werkt waterstof als een reductiemiddel, dat wordt geoxideerd door zuurstof.
- Voorbeelden van oxidatiemiddelen:
- Bij de productie van azijn: wanneer wijn wordt blootgesteld aan lucht, verandert het in azijn, waarvan het hoofdbestanddeel azijnzuur is. Dit komt omdat de ethylalcohol of ethanol die in wijn aanwezig is, oxideert bij contact met zuurstof uit de lucht, wat resulteert in azijnzuur. Zuurstof is dus een oxidatiemiddel. Zelfs de oorsprong van de term "oxidatie" houdt verband met de reactie met zuurstof.

- In de roest: zoals vermeld in het vorige voorbeeld, werkt zuurstof als een oxidatiemiddel voor alcohol; en het doet dit ook in contact met verschillende metalen, zoals ijzer, die het roestproces veroorzaken. Naast zuurstof in de lucht zijn andere oxidatiemiddelen in dit geval water of een zure oplossing.
- In bleekmiddelen: het blekende effect van de bleekmiddelen is te wijten aan de aanwezigheid van de volgende twee reductiemiddelen: o hypochlorietanion (meestal in de vorm van natriumzout - NaOCl), bijvoorbeeld aanwezig in bleekmiddel; en waterstofperoxide (H2O2), op de markt gebracht als waterstofperoxide. Deze twee verbindingen hebben een zeer sterke neiging om te oxideren en de reductie van andere chemische soorten te veroorzaken. Daarom zijn ze verantwoordelijk voor oxiderende stoffen die donkere kleuren aan producten geven. In cellulose wordt lignine bijvoorbeeld afgebroken en wordt het lichter en kneedbaarder. Bij het verwijderen van vlekken en het bleken van textiel veroorzaken deze oxidatiemiddelen de oxidatie van organische moleculen zoals vetten en kleurstoffen.

- In ademanalyses: een eenvoudige blaastest voor eenmalig gebruik bestaat uit een doorzichtige buis met een waterige oplossing van het dichromaatzout van kalium en silica, bevochtigd met zwavelzuur; gemengd met oranje kleur. Dit zout, in contact met de alcoholdamp in de adem van de dronken bestuurder, reageert en verandert de kleur in groen. Dit betekent dat de oxidatie van ethanol (alcohol) tot ethanal wordt veroorzaakt.

Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm
