Leer de eerste wet van de thermodynamica toepassen in verschillende situaties, los oefeningen op en test je kennis met opgeloste en uitgelegde oefeningen.
vraag 1
De eerste wet van de thermodynamica stelt dat:
a) Energie kan niet worden gecreëerd of vernietigd, maar het kan wel van de ene vorm in de andere worden omgezet.
b) Energie wordt altijd behouden, maar kan niet van de ene vorm in de andere worden omgezet.
c) Energie kan worden gecreëerd of vernietigd, maar het kan niet van de ene vorm in de andere worden omgezet.
d) Energie kan niet worden behouden, maar kan wel van de ene vorm in de andere worden omgezet.
De eerste wet van de thermodynamica is het principe van behoud van energie, dus in een systeem gesloten blijft de hoeveelheid energie constant en kan alleen van de ene vorm in de andere worden omgezet. ander.
vraag 2
Ga uit van een gesloten systeem dat 100 J warmte ontvangt terwijl het 50 J arbeid verricht. Wat is de verandering in interne energie van het systeem?
a) -50 J
b) 0 J
c) 50J
d) 100J
e) 150J
Controle van de borden:
Ontvangen warmte is positief Q > 0.
Verrichte arbeid is positief W > 0.
Volgens de eerste wet hebben we:
vraag 3
Een ideaal gassysteem wisselt 500 joule warmte uit met de externe omgeving. Ervan uitgaande dat dit proces een isometrische koeling is, bepaal respectievelijk het werk en de interne energie.
a) 500 J en 0 J
b) - 500 en 0 J
c) 0 J en 500 J
d) 0 J en - 500 J
e) -500 J en 500 J
Omdat het proces isometrisch is, is er geen verandering in volume, dus het werk is nul.
Volgens de eerste wet van de thermodynamica:
Omdat het een koeling is, verliest het systeem warmte, dus:
vraag 4
8 mol van een ideaal gas in een zuiger-cilindersysteem wordt gecomprimeerd door 1000 J arbeid te verrichten. Tijdens het proces gaat 400 J aan warmte verloren aan de externe omgeving. Zijn interne energie en de verandering in zijn temperatuur zijn respectievelijk gelijk aan
Gegeven: R = 8,31 J/mol. K
a) - 1400 J en geschatte variatie van 6 K
b) 600 J en geschatte variatie van 6 K
c) 600 J en geschatte variatie van 14 K
d) - 1400 J en geschatte variatie van 14 K
interne energie
Naarmate het systeem werk ontvangt, is het teken negatief, evenals de warmte die in dit proces verloren gaat.
De eerste wet van de thermodynamica luidt:
Als we de waarden vervangen, krijgen we:
R = 8,31 J/mol K
Temperatuur
Volgens de wet van Joule hebben we:
vraag 5
Een perfect gas ondergaat compressie en doet 500 J werk. Aan het einde van deze transformatie veranderde de interne energie van het systeem 200 J minder dan aan het begin. De hoeveelheid warmte die door het gas werd uitgewisseld was
a) - 700 J
b) - 300 J
c) 300J
d) 0J
e) 700J
Aangezien het werk is ontvangen, dat wil zeggen resistent werk, is het teken negatief.
Vervanging van de waarden in de vergelijking van de eerste wet van de thermodynamica:
vraag 6
(CEDERJ 2021) In een fase van de cyclus die wordt uitgevoerd door een ideaal gas in een airconditioner, wordt de gasdruk verhoogd terwijl het volume constant blijft. In dit stadium van de cyclus zijn de arbeid W die door het gas wordt verricht, de hoeveelheid warmte Q die erdoor wordt geabsorbeerd en de verandering ΔT in de temperatuur respectievelijk:
a) W < 0, Q < 0 en ΔT < 0
b) W = 0, Q > 0 en ΔT > 0
c) W = 0, Q = 0 en ΔT = 0
d) W > 0, Q > 0 en ΔT > 0
Gegevens:
Druk P neemt toe;
Volume blijft constant;
Werk
Omdat het volume constant is, is de arbeid W gelijk aan nul.
De eerste wet van de thermodynamica gaat als volgt:
Aangezien warmte positief is, zal de verandering in interne energie ook positief zijn.
Warmte
Omdat warmte wordt geabsorbeerd, is deze positief.
Temperatuur
Volgens de gaswet:
Waar,
n is het aantal mol
R is de universele gasconstante
De temperatuur hangt dus alleen af van de druk, aangezien het volume constant is en positief is.
vraag 7
(UNICENTRO 2018) Volgens de eerste wet van de thermodynamica is de verandering in de interne energie van een systeem, ΔU, gegeven door het verschil tussen de warmte die wordt uitgewisseld met de buitenomgeving, Q, en het werk, W, dat tijdens het proces wordt gedaan thermodynamisch. Gezien deze informatie, als een monatomisch gas uitzet om altijd op dezelfde temperatuur te blijven, kan deze transformatie worden weergegeven door de vergelijking
a) ΔU + W = 0
b) ΔU − W =0
c) Q − W = 0
d) Q + ΔU = 0
Isotherm proces vindt plaats zonder temperatuurverandering.
Energie is gerelateerd aan temperatuur door:
Waarbij n het aantal mol is en R de universele gasconstante. Aangezien n en R constant zijn, is er alleen temperatuurvariatie, en
De eerste wet van de thermodynamica gaat als volgt:
vraag 8
(URCA 2016) Volgens de eerste wet van de thermodynamica als tijdens een isotherm proces dat wordt ondergaan door een ideaal gas met een vaste massa, het gas vrijkomt een hoeveelheid warmte waarvan de grootte 50 cal is, dan zijn de verandering in interne energie en het werk dat door het gas in dit proces wordt gedaan, respectievelijk:
a) 0 en 50 cal.
b) 50 kcal en 0.
c) 0 en 0.
d) 50 cal en -50 cal.
e) 0 en -50 cal.
De verandering in interne energie is direct gerelateerd aan de verandering in temperatuur. Omdat het proces isotherm is, is er dus geen temperatuurverandering .
Uit de eerste wet van de thermodynamica:
Omdat er warmte vrijkomt, is het teken negatief.
vraag 9
(UFRN 2012) Biomassa is een van de belangrijkste bronnen van hernieuwbare energie en daarom zijn machines die het gebruiken als brandstof voor energieopwekking belangrijk vanuit milieuoogpunt. Een veel voorkomend voorbeeld is het gebruik van biomassa om een stoomturbine aan te drijven om arbeid te genereren. De figuur hiernaast toont schematisch een vereenvoudigde thermo-elektrische centrale.
In deze thermo-elektrische installatie wordt door de verbranding van biomassa in de oven warmte geproduceerd, die het water in de ketel verwarmt en stoom onder hoge druk genereert. De stoom wordt op zijn beurt door pijpen naar de turbine geleid, die onder zijn werking zijn wieken begint te draaien.
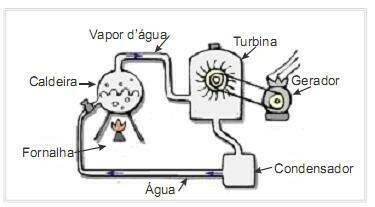
Ga ervan uit dat warmteverliezen door temperatuurverschillen tussen de onderdelen van deze warmtemotor en de omgeving verwaarloosbaar zijn. In dit verband de variatie in de interne energie van het ketelwater
a) groter is dan de som van de warmte die eraan wordt geleverd door de verbranding van de biomassa en het werk aan de turbine.
b) is gelijk aan de som van de warmte die eraan wordt geleverd door de biomassa te verbranden met het werk aan de turbine.
c) is gelijk aan het verschil tussen de geleverde warmte door de verbranding van de biomassa en de arbeid die aan de turbine is verricht.
d) groter is dan het verschil tussen de geleverde warmte door de verbranding van de biomassa en het werk aan de turbine.
Het water in de ketel ontvangt energie in de vorm van warmte door de verbranding van de brandstof en geeft energie vrij in de vorm van arbeid aan de turbine.
vraag 10
(UECE 2021) Let met betrekking tot de eigenschappen van gassen op de volgende uitspraken:
i. Voor een ideaal gas is interne energie alleen een functie van druk.
II. De warmte die door een gas wordt opgenomen wanneer het van toestand verandert, is onafhankelijk van het proces.
III. De interne energie van een ideaal gas is alleen een functie van temperatuur en is onafhankelijk van het proces.
IV. Bij een isotherme uitzetting van een ideaal gas is de arbeid die het verricht gelijk aan de geabsorbeerde warmte.
Het klopt alleen wat er in staat
a) I en II.
b) III en IV.
c) I en IV.
d) II en III.
III. JUIST. De interne energie van een ideaal gas is alleen een functie van temperatuur en is onafhankelijk van het proces.
De verandering in interne energie is direct gerelateerd aan de verandering in temperatuur.
Waar n het aantal mol is en R de ideale gasconstante is, omdat het constanten zijn, bepaalt alleen de temperatuur de interne energie van het gas.
IV. JUIST. Bij een isotherme uitzetting van een ideaal gas is de arbeid die het verricht gelijk aan de geabsorbeerde warmte.
Omdat het isotherm is, is er geen verandering in temperatuur, dus de verandering in interne energie is nul. Volgens de eerste wet van de thermodynamica:
Meer informatie met:
- Eerste wet van de thermodynamica
- Thermodynamica: wetten, concepten, formules en oefeningen
- Oefeningen op thermodynamica
- gas wet
ASTH, Rafaël. Oefeningen van de eerste wet van de thermodynamica.Alle materie, [n.d.]. Beschikbaar in: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Toegang bij:
Zie ook
- Oefeningen op thermodynamica
- Thermodynamica
- adiabatische transformatie
- Oefeningen op Thermochemie
- Eerste wet van de thermodynamica
- Natuurwetenschappen en hun technologieën: Enem
- Thermische energie
- Tweede wet van de thermodynamica
