Naar de zuurstof functie zijn een groep van organische bestanddelen die zuurstofatomen hebben die aan de koolstofketen zijn bevestigd. Zijn zij:
alcohol;
keton;
aldehyd;
carbonzuur;
ester;
ether.
Lees ook:Koolwaterstoffen — verbindingen bestaande uit koolstof en waterstof
Samenvatting over de zuurstoffunctie
Zuurstoffuncties zijn een groep verbindingen die een zuurstofatoom bevatten. zuurstof direct aan de koolstofketen bevestigd.
De verschillende zuurstoffuncties worden gekenmerkt door een specifieke structurele opstelling van atomen, een functionele groep genoemd.
De functionele groepen zijn verantwoordelijk voor de eigenschappen van elke organische functie.
De zuurstoffuncties zijn: alcohol, keton, aldehyde, carbonzuur, ester en ether.
Videoles over zuurstoffunctie
Wat zijn de zuurstoffuncties?
Zuurstofrijke lichaamsfuncties zijn die hebben een zuurstofatoom gebonden aan een zuurstofatoom koolstof van de koolstofketen.
De zuurstoffuncties zijn:
alcohol;
keton;
aldehyde;
carbonzuur;
ester;
ether.
De organische functies
worden geïdentificeerd door hun functionele groep, wat een structurele rangschikking is van atomen of bindingen, verantwoordelijk voor de karakteristieke eigenschappen van die reeks verbindingen.Belang van zuurstoffuncties
De aanwezigheid van zuurstoffuncties in organische verbindingen is in staat om de eigenschappen van verbindingen te veranderen, vergeleken met de respectieve koolwaterstof, met een gelijk aantal koolstofatomen.
Zuurstoffuncties worden gekenmerkt door het voorkomen van hydroxyl-, carbonyl- of carboxylgroepen. A aanwezigheid van het zuurstofatoom verhoogt het polaire karakter verbindingen, waardoor ze meer hydrofiel worden, dat wil zeggen, hun affiniteit voor water.
Optreden van zuurstoffuncties is ook verantwoordelijk voor het type intermoleculaire krachtwerken tussen moleculen. De aard en intensiteit van intermoleculaire krachten beïnvloeden de oplosbaarheid en de smelt- en kooktemperaturen.
De onderstaande tabel geeft een vergelijking tussen enkele eigenschappen van drie verbindingen die hetzelfde aantal koolstofatomen hebben, maar verschillen door de aanwezigheid van geoxygeneerde functionele groepen.
Biologische kompost | |||
Butaan (C4H10) |
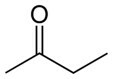
Butanon (C4H8O) |
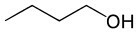
Butanol (C4H10O) |
|
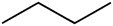 |
 |
 |
|
organische functie |
Koolwaterstof |
keton (zuurstof functie) |
Alcohol (zuurstof functie) |
Polariteit |
apolair |
Polair |
Polair |
smelttemperatuur |
-138,3°C |
-86°C |
-89°C |
kokende temperatuur |
-0,5°C |
80°C |
118°C |
Overheersende intermoleculaire kracht |
Geïnduceerde dipool |
permanente dipool |
waterstofbruggen |
Alcohol
De organische functie alcohol heeft een hydroxylgroep (-OH) direct gebonden aan verzadigde koolstof, dat wil zeggen, dat koolstofatoom dat alleen enkele bindingen tot stand brengt.
Functionele groep alcoholen: R-OH (hydroxyl).
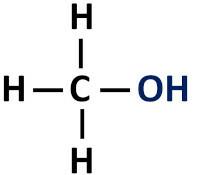
alcoholen zijn geclassificeerd volgens het type koolstof waaraan de hydroxyl is bevestigd. Primaire alcoholen hebben de hydroxyl gehecht aan de primaire koolstof. Secundaire alcoholen hebben de hydroxylgroep bevestigd aan een secundaire koolstof, en tertiaire alcoholen hebben hun -OH-groep bevestigd aan tertiaire koolstofatomen.
Een organische verbinding die slechts één hydroxyl bevat, wordt een monoalcohol genoemd. Als het twee hydroxylgroepen heeft, wordt het een dialcohol genoemd. Daarboven worden de moleculen polyalcoholen genoemd.
A nomenclatuur voor alcoholen volgt de aanbeveling van Iupac (International Union of Pure and Applied Chemistry), gezien de samenstelling van de naam van chemische structuren in drie delen:
Voorvoegsel - gerelateerd aan het aantal koolstofatomen.
Tussenvoegsel - verwijst naar het type chemische binding tussen koolstofatomen.
Achtervoegsel - gerelateerd aan de functionele groep. In het geval van alcoholen is het gebruikte achtervoegsel -Hallo.
Zie voorbeelden:
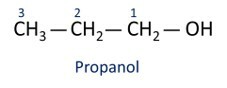
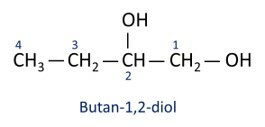
O belangrijkste alcohol is ethaanik (CH3CH2OH), gebruikt als brandstof, in alcoholische dranken, als chemisch oplosmiddel, reinigingsmiddel en ontsmettingsmiddel.
keton
De organische ketonfunctie komt overeen met de functionele carbonylgroep (C=O), gelokaliseerd tussen twee koolstofatomen van de koolstofketen.
Functionele groep ketonen: R1–(C=O)–R2.

Ketonen zijn geclassificeerd volgens het aantal carbonylgroepen:
Monoketones - hebben een enkele carbonylgroep.
diketonen - hebben twee carbonylgroepen.
Polytonen - hebben meer dan twee carbonylgroepen.
A nomenclatuur voor ketonen volgt de Iupac-regels, maar met een verschil in de spelling van het achtervoegsel. Ketonen worden geïdentificeerd door het achtervoegsel -op een.
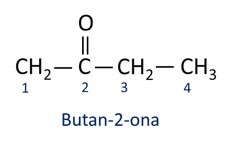
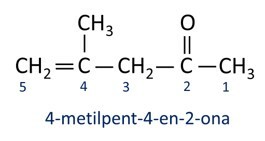
Over het algemeen vinden ketonen toepassing bij de vervaardiging van andere chemicaliën en farmaceutische producten. In de industrie worden ketonen gebruikt als oplosmiddelen voor verven, kleurstoffen en vernissen. Een van de meest bekende ketonen is propanon, in de volksmond bekend als aceton. Acetonoplossingen worden gebruikt voor het verwijderen van nagellak.
Lees ook:Amiden — verbindingen met een stikstofatoom aan de carbonylgroep
aldehyde
De organische aldehydefunctie is gekenmerkt door de aanwezigheid van de functionele carbonylgroep, waarvan het koolstofatoom een waterstofbrug heeft.
Functionele groep van aldehyden: H-C=O (formyl).
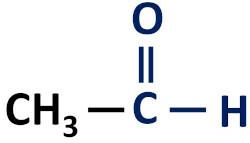
Aldehyden komen altijd voor aan het einde van koolstofketens omdat hun koolstofatoom gebonden moet zijn aan ten minste één waterstofatoom.
A nomenclatuur voor aldehydeverbindingen volgt de IUPAC-regels, die verschillen door het achtervoegsel. Aldehyden worden geïdentificeerd door het achtervoegsel -al.
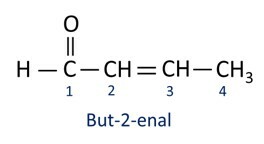
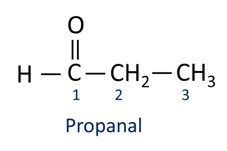
Aldehyden worden industrieel gebruikt bij de vervaardiging van parfums en smaakstof, omdat de geur en smaak variëren afhankelijk van de lengte van de koolstofketen. Aldehydeverbindingen worden ook gebruikt bij de vervaardiging van onder andere schoonmaakproducten, medicijnen en polymeren. Aldehyden met een korte koolstofketen kunnen worden gebruikt als conserveringsmiddel, zoals de beroemde formaline, een aldehyde genaamd methanal.

carbonzuur
De organische carbonzuurfunctie wordt geïdentificeerd door de aanwezigheid van de carboxylfunctionele groep (-COOH).
Functionele groep carbonzuren: –(C=O)OH of –COOH.

Verbindingen die tot deze organische functie behoren, zijn zwakke zuren, omdat ze gemakkelijk H-ionen afgeven+ in waterige oplossing.
A nomenclatuur voor carbonzuren volgt de Iupac-regels, maar de term "zuur" verschijnt voor het voorvoegsel dat het koolstofgetal aangeeft, en het gebruikte achtervoegsel is -oic.
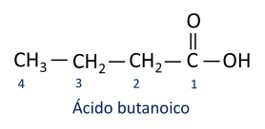
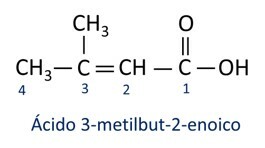
O meest voorkomende carbonzuur in het dagelijks leven is de Azijnzuur, stof aanwezig in azijn. Vitamine C, overvloedig aanwezig in veel citrusvruchten, is een organisch molecuul dat ascorbinezuur wordt genoemd.
Ester
De organische esterfunctie wordt geïdentificeerd door de aanwezigheid van de functionele carbonylgroep, waarvan het koolstofatoom een zuurstofligand heeft.
Functionele groep van esters: –R–(C=O)O–R'.
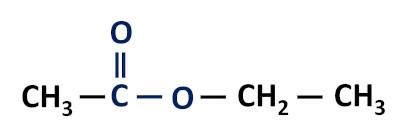
De esters zijn derivaten van carbonzuren, die hiervan verschillen doordat ze een alkylradicaal hebben dat aan het zuurstofatoom is bevestigd in plaats van aan het waterstofatoom.
Moleculen die behoren tot de esterfunctie worden gevormd door de reactie tussen een carbonzuur en een alcohol, een reactie die bekend staat als verestering.
De regels voor naamgeving van esters gedefinieerd door Iupac zijn van mening dat het molecuul uit twee delen bestaat:
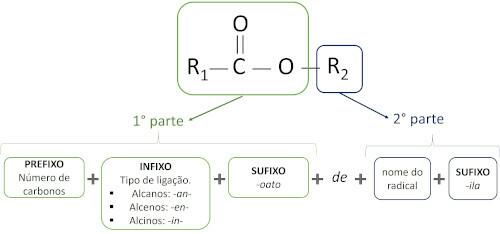
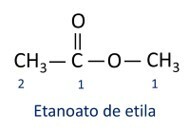
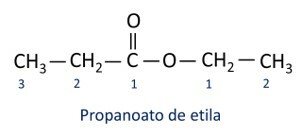
Het belangrijkste kenmerk van esters is hun vermogen om smaak en aroma te simuleren van natuurlijke voedingsmiddelen, volgens de lengte van koolstofketens (R1 en R2). Hierdoor worden esters veel gebruikt als smaakstof in de voedingsmiddelenindustrie, bij de productie van farmaceutica, parfums en cosmetica.
Ether
De ether organische functie is gekenmerkt door een zuurstofatoom tussen twee koolstofketens.
Functionele groep ethers: R – O – R.

Ethers zijn licht ontvlambare stoffen, met een karakteristieke en sterke geur.
A officiële Iupac-nomenclatuur voor ethers volgt het ordervoorvoegsel + tussenvoegsel + achtervoegsel. De kant van het molecuul die minder koolstofatomen heeft, krijgt echter het achtervoegsel -oxy, terwijl de langere koolstofketen wordt genoemd alsof het een koolwaterstof is en het achtervoegsel -o krijgt.
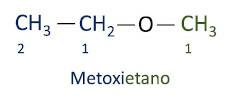
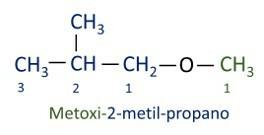
De ethers zijn gebruikt als oplosmiddelen voor verven, harsen, oliën en vetten. Als gevolg hiervan worden ze gebruikt in verschillende industriële en farmaceutische processen. Ether werd ooit gebruikt als verdovingsmiddel en wordt tegenwoordig vervangen door andere veiligere stoffen.
Lees ook:Nitroverbindingen — verbindingen die nitrogroepen (NO2) in hun molecuul bevatten
Opgeloste oefeningen over zuurstoffuncties
vraag 1
(Uece) In de organische chemie wordt een functionele groep gedefinieerd als een moleculaire structuur die stoffen vergelijkbaar chemisch gedrag geeft. De verzameling verbindingen met dezelfde functionele groep wordt organische functie genoemd. Markeer de optie die de verbinding correct weergeeft en de organische functie waartoe deze behoort.

Oplossing:
Brief C
Van de alternatieven is item C de enige die de functionele groep correct uitdrukt in de naam van de chemische functie. De organische esterfunctie wordt gedefinieerd door de carbonylfunctionele groep, waarvan het koolstofatoom ook een zuurstofligand heeft.
In item A wordt de etherfunctionele groep uitgedrukt.
In item B wordt de ketonfunctionele groep uitgedrukt.
In item D wordt de amidefunctionele groep uitgedrukt. aminen Het is amiden behoren tot de stikstoffuncties.
vraag 2
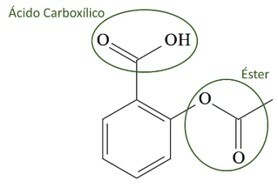
(UCS-RS) In de 5e eeuw voor Christus. C., Hippocrates, Griekse arts, schreef dat een product van wilgenschors pijn verlichtte en koorts verlaagde. Ditzelfde product, een zuur poeder, wordt zelfs genoemd in teksten uit de oude beschavingen van het Midden-Oosten, Sumerië, Egypte en Assyrië. Inheemse Amerikanen gebruikten het ook tegen hoofdpijn, koorts, reuma en tremoren. Dit medicijn is een voorloper van aspirine, waarvan de chemische structuur hieronder wordt weergegeven.
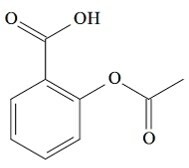
De organische functies die aanwezig zijn in de structuur van aspirine, hierboven weergegeven, zijn:
a) carbonzuur en ester.
b) alcohol en ether.
c) amine en amide.
d) amine en ether.
e) aminozuur en alcohol.
Oplossing:
Letter A
Door Ana Luiza Lorenzen Lima
Scheikundeleraar
Bron: Braziliaanse school - https://brasilescola.uol.com.br/quimica/funcoes-oxigenadas.htm


