Bij verbrandingsreacties ze zijn aanwezig in veel aspecten van ons dagelijks leven. De belangrijkste bronnen van energieopwekking zijn bijvoorbeeld het resultaat van de verbranding of verbranding van bepaalde brandstoffen, zoals ethanol, benzine en houtskool. Bovendien is de energie die we nodig hebben om te overleven en om te werken het resultaat van verbrandingsreacties die plaatsvinden in onze cellen wanneer we het voedsel dat we eten "verbranden".
Maar wat is er nodig om een verbrandingsreactie te krijgen?
Er zijn drie dingen nodig:
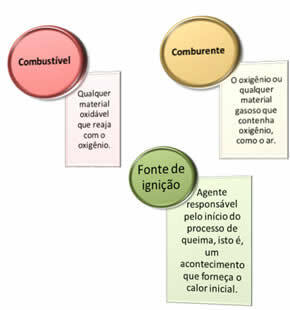
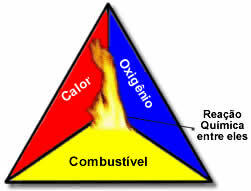
Deze drie factoren vormen de vuur driehoek, want zodra de verbrandingsreactie begint, ondersteunt de vrijgekomen energie de reactie en laat deze doorgaan totdat de brandstof, oxidatiemiddel of warmte (vrijgekomen energie) op is. Dit betekent dat er een Kettingreactie.
Als iemand bijvoorbeeld een brandende sigaret in een bos gooit, ontstaat er brand (verbrandingsreactie). In dit geval is de Struik het is de brandstof, O zuurstof aanwezig in de lucht sfeervol is de
oxidatiemiddel het is de sigaret verlicht was de ontstekingsbron. Dit branden gaat door totdat een van de drie factoren is geëlimineerd. Als brandweerlieden met water gooien, wordt de hitte geëlimineerd. Maar zelfs als er niets wordt gedaan om deze verbranding te stoppen, zal het op een gegeven moment eindigen, dat wil zeggen, wanneer de brandstof (bos) opraakt.Zoals reeds vermeld, komt bij deze reacties warmte vrij, waardoor verbranding een exotherme reactie is. Dit type reactie is echter onvolledige verbranding. Om te begrijpen waarom, zie het verschil tussen volledige en onvolledige verbranding:
Volledige verbranding:
Als we organische verbindingen als brandstoffen analyseren, moeten we:
| DE volledige verbranding het zal optreden wanneer de koolstofketen wordt verbroken en alle koolstofatomen in de koolstofketen volledig zijn geoxideerd. |
| Jij gevormde producten door koolwaterstoffen zal de CO2 (kooldioxide) en H2O (Water). |
Observeer de volledige verbranding van isooctaan, een van de componenten van benzine.
C8H18 (g) +25/2 O2 (g) → 8 CO2(g) + 9 uur2O(1)
onvolledige verbranding
| In dit geval is er niet genoeg oxidatiemiddel, dat wil zeggen voldoende zuurstof om alle brandstof te verbranden. |
| De gevormde producten zijn dus: CO (koolmonoxide) en H2O. |
Observeer dezelfde verbranding van isoctaan, echter nu onvolledig:
C8H18 (g) + 17/2 O2(G) → 8 CO (G) + 9 uur2O(1)
Het verbranden van bossen is een voorbeeld, omdat de resulterende uitstoot bestaat uit CO en bepaalde stoffen, zoals roet (C), evenals as en andere eenvoudige en complexe organische verbindingen. Stikstofoxide, ozon en aldehyden kunnen ook worden gevormd als gevolg van secundaire reacties door de aanwezigheid van andere componenten in de lucht.
C8H18 (g) + 9/2 O2 (g) → 8C (G) + 9 uur2O(1)
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Brazilië School Team
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm