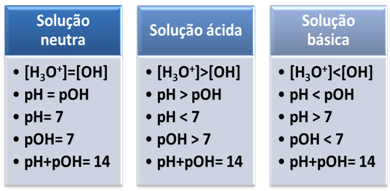
Een medium wordt als neutraal beschouwd als het dezelfde concentratie, in mol/L, van de hydroniumionen (H3O+) en hydroxide (OH-).
Een voorbeeld van een neutraal medium dat zelfs als standaard dient voor andere oplossingen is zuiver, gedestilleerd water met een temperatuur van 25ºC. Bij deze temperatuur heeft het precies 1. 10-7 mol/L van beide ionen. Vandaar dat uw ionische product (Kmet wie) is gelijk aan 10-14 (mol/L)2:
Kmet wie = [H3O+]. [Oh-]
Kmet wie = (1. 10-7 mol/l). (1. 10-7 mol/L) = 10-14 (mol/L)2
De pH en pOH worden hieronder gegeven:
pH= - log [H3O+] pOH= -log[OH-]
pH= - log1. 10-7 pOH= - log 1. 10-7
pH = 7pOH = 7
Dit laat ons zien dat in een neutrale oplossing de pH is gelijk aan pOH.
- Zuur middel:
In een zuur medium is de concentratie van H-ionen3O+ groter is dan die van OH-ionen-.
Zo'n oplossing kan worden bereikt door een klein deel van de H-ionen toe te voegen3O+bijvoorbeeld door middel van een zuur.
Volgens het principe van Le Chatelier, wanneer een verstoring wordt veroorzaakt in een systeem in evenwicht, heeft het de neiging zichzelf opnieuw aan te passen om de effecten van deze kracht te verminderen. Dit betekent dat als een zuur aan water wordt toegevoegd, de H-ionen
3O+ ze zullen in overmaat zijn en de balans zal verschuiven in de omgekeerde reactierichting, naar links. Dus deze overtollige ionen zullen reageren met de OH-ionen-. Dus de concentratie van OH-ionen- zal afnemen en de oplossing zal zuur worden.
Het ionische product (Kw) is altijd gelijk aan 10-14, maar de concentratie van H-ionen3O+ groter is dan de concentratie van OH-ionen-1. Daarom is de pH groter dan de pOH in een zuur milieu, maar de som is altijd gelijk aan 14.
Ook, hoe groter de concentratie van H-ionen3O+, hoe hoger de pH-waarde. Bij kamertemperatuur (25°C), pH < 7 en pOH > 7.

- Basis betekent:
In het basismedium is de concentratie van OH-ionen- is groter dan die van H ionen3O+.
Als we een base aan water toevoegen, betekent dit dat we OH-ionen toevoegen.- en, zoals uitgelegd in het vorige item, volgens het principe van Le Chatelier, het evenwicht van de reactie van zelf-ionisatie van water zal in de tegenovergestelde richting bewegen, waarbij overtollige ionen reageren met H-ionen3O+, uw concentratie verminderen en de oplossing basisch maken.
In dat geval zal de pOH groter zijn dan de pH. Bij kamertemperatuur (25°C), pH > 7 en pOH < 7.

Kort:
Door Jennifer Fogaça
Afgestudeerd in scheikunde

