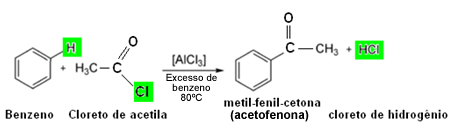
De valentielaag is de laatste laag van de elektronische distributie van een atoom. Omdat het de buitenste laag is, is het ook het verst verwijderd van de atoomkern.
Volgens de Octetregel, heeft de valentieschil acht elektronen nodig om te stabiliseren.
Atomen krijgen dus stabiliteit wanneer ze 8 elektronen in de valentieschil hebben. Dit gebeurt met edelgassen, die hebben de volledige valentielaag. De enige uitzondering is het element Helium dat 2 elektronen heeft.
De andere elementen moeten chemische bindingen maken om de ontbrekende elektronen te ontvangen en de acht elektronen in de valentieschil te bereiken.
De valentie-schilelektronen zijn degenen die deelnemen aan de bindingen, omdat ze het meest extern zijn.
Elektrosfeerlagen
Volgens het atoommodel van Rutherford-Bohr draaien elektronen rond de atoomkern, in verschillende energetische lagen.
Er zijn zeven lagen die worden aangeduid met de letters K, L, M, N, O, P en Q. Elk ondersteunt een maximaal aantal elektronen.
 Elektronische lagen en het aantal elektronen dat ze ondersteunen
Elektronische lagen en het aantal elektronen dat ze ondersteunen
Lees ook:
- atoommodel van Bohrhr
- Rutherford atoommodel
- Edelgassen
- Octetregel
Hoe de Valencia-laag bepalen?
De valentielaag kan op twee manieren worden bepaald: Elektronische distributie en Periodiek systeem.
Om de valentielaag te bepalen door middel van elektronische distributie, de Linus Pauling-diagram.
 Pauling-diagram
Pauling-diagram
Bedenk dat het Pauling-diagram de toenemende volgorde van energie volgt. De laatste laag die in de elektronische distributie wordt verkregen, is de valentielaag.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Dus in de valentielaag is het meest energetische subniveau de laatste laag.
Voorbeelden:
Stikstof - N
Atoomnummer: 7
Elektronische distributie: 1s2 2s2 2p3
Valencia laag: 2s2 2p3, N heeft 5 elektronen in de valentieschil.
IJzer - Fe
Atoomnummer: 26
Elektronische distributie: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Valencia laag: 4s2, Fe heeft 2 elektronen in de valentieschil.
Chloor - Cl
Atoomnummer: 17
Elektronische distributie: 1s2 2s2 2p6 3s2 3p5
Valencia laag: 3s2 3p5, Cl heeft 7 elektronen in de valentieschil.
Zuurstof - O
Atoomgetal: 8
Elektronische distributie: 1s2 2s2 2p4
Valencia laag: 2s2 2p4, zuurstof heeft 6 elektronen in de valentieschil.
Koolstof - C
Atoomgetal: 6
Elektronische distributie: 1s2 2s2 2p2
Valencia laag: 2s2 2p2, koolstof heeft 4 elektronen in de valentieschil.
Lees ook over Kwantumgetallen.
Tot nu toe waren de gebruikte voorbeelden met elementen in grondtoestand. Maar hetzelfde principe kan worden gebruikt voor: ionen, kationen en anionen. Zie het voorbeeld:
Chloride-anion - Cl-
Het atoomnummer van chloor is 17. Als het in de grondtoestand zou zijn, zou het aantal elektronen gelijk zijn aan het aantal protonen. In dit geval is er echter een winst van 1 elektron.
Maak eerst de elektronische distributie voor het chloorelement:
1s2 2s2 2p6 3s2 3p5
Voeg met de versterking van een extra elektron de laatste laag toe:
1s2 2s2 2p6 3s2 3p6. Er zijn dus 8 elektronen in de valentieschil (3s2 3p6).
Zie ook: Oefeningen over elektronische distributie.
Om de valentielaag via het periodiek systeem te bepalen, is het noodzakelijk om de periode en de elementfamilie te identificeren.
Dus, terwijl de 1A-familie 1 valentie-elektron heeft, heeft 2A er 2, enzovoort. De chemische elementen die erin zitten periodiek systeem familie hetzelfde aantal elektronen in de valentieschil hebben.
Dit geldt echter alleen voor de groepen 1, 2, 13, 14, 15, 16 en 17 die respectievelijk de volgende aantallen elektronen in de valentieschil 1, 2, 3, 4, 5, 6 en 7 hebben.
Voor elementen waar deze relatie niet mogelijk is, moet elektronische distributie worden gebruikt.
Niet vergeten! Bij chemische bindingen ontstaan uit de behoefte om atomen te stabiliseren en zo moleculen te vormen. Dit wordt gedaan door elektronen af te staan uit de valentieschil, die, omdat ze verder van de kern verwijderd zijn, de neiging hebben om te doneren.
Lees ook over Moleculaire Geometrie.
Opdrachten
1. Zoek de valentielaag van de volgende elementen:
Broom
35br
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
De valentieschil van broom (7A-familie) heeft 7 elektronen. Dat komt omdat 4s2 en 4p5 behoren tot de N-laag, terwijl 3d10 behoort tot laag M.
Aluminium
13Al
1s2 2s2 2p6 3s2 3p1
De aluminium valentieschaal (3A-familie) heeft 3 elektronen.
2. (UFSC) Het aantal elektronen in elk subniveau van het strontiumatoom (38Sr) in oplopende volgorde van energie is:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
3. (IFSP/2013) Het aantal elektronen in de valentieschil van het calciumatoom (Z = 20), in de grondtoestand, is
naar 1
b) 2
c) 6
d) 8
e) 10
b) 2
Controleer toelatingsexamenvragen met een becommentarieerde resolutie in: Oefeningen op het periodiek systeem.