DE distillatie is een methode voor het scheiden van homogene mengsels, dat wil zeggen wanneer de componenten zich in een enkele fase bevinden.
Er zijn twee soorten distillatie. Eenvoudige destillatie wordt gebruikt in vaste stof-vloeistofscheiding en gefractioneerde destillatie in een mengsel van vloeistoffen die met elkaar mengbaar zijn.
Om een bepaalde component van een mengsel te kunnen isoleren is het nodig om een variabele aan te passen. In het geval van destillatie vindt scheiding plaats door de temperatuur te veranderen, zodat de betreffende component zijn fysieke toestand verandert.
De eigenschap van de stoffen die in dit proces worden gebruikt, is de kookpunt, dat wil zeggen, de temperatuur waarbij de verandering van vloeistof naar gas plaatsvindt.
distillatie proces
Het destillatieproces bestaat uit het leveren van warmte aan een mengsel totdat het kookpunt van de betreffende component is bereikt en het overgaat in een gasvormige toestand, waarbij het zich van de andere scheidt.
Daarna gaat het gas door een koelkolom, waar warmte van de stof wordt verwijderd totdat deze het smeltpunt bereikt en dus terugkeert naar een vloeibare toestand. Dit materiaal wordt naar een andere container geleid.
eenvoudige distillatie
Om een homogeen mengsel te scheiden van: vaste stof opgelost in vloeistof eenvoudige distillatie wordt gebruikt.
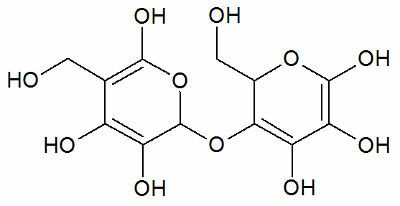
In de onderstaande afbeelding zien we de basisuitrusting voor het scheidingsproces.

Zijn zij:
- destillatiekolf (1), die het mengsel bevat;
- Verwarmingsdeken (2), die warmte aan het mengsel geeft;
- Thermometer (3), om de temperatuurverandering te controleren;
- Condensor (4), om de verdampte component te koelen en
- Beker (5), om de afgescheiden component in vloeibare toestand op te vangen.
Dit proces kan bijvoorbeeld worden gebruikt om natriumchloride (NaCl), bekend als keukenzout, en water te scheiden. Het zout heeft een kookpunt van 1465 °C en lost op in water tot een homogeen mengsel.
Omdat water een kookpunt heeft van 100 ºC, verandert het gemakkelijk in een gasvormige toestand en wordt het van het mengsel gescheiden, terwijl het zout kristalliseert en in vaste toestand in de container blijft.
De waterdamp verlaat de bovenkant van de destillatiekolf en gaat door een condensor. Koud of koud water circuleert op de wanden van deze apparatuur. De uitwisseling van warmte tussen de vloeistoffen zorgt ervoor dat de afgescheiden component van het mengsel warmte verliest en terugkeert naar een vloeibare toestand om in een andere container te worden opgevangen. Deze vloeistof wordt destillaat genoemd.
gefractioneerde destillatie
Om een homogeen mengsel te scheiden van: met elkaar mengbare vloeistoffen en bij een groot verschil tussen kooktemperaturen wordt gefractioneerde destillatie toegepast.
Deze methode is gefractioneerd omdat de componenten in het mengsel van het mengsel worden gescheiden oplopende volgorde van kookpunt, dat wil zeggen, beginnend met de laagste tot degene die de hoogste temperatuur nodig heeft om de fase te veranderen.
In de onderstaande afbeelding is er de apparatuur die wordt gebruikt om de methode uit te voeren.
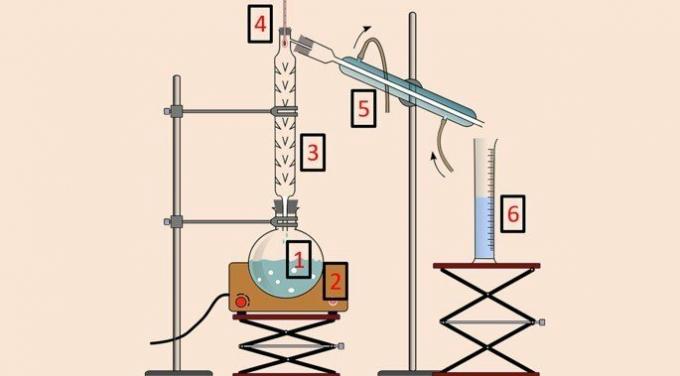
Net als bij eenvoudige destillatie worden destillatiekolf (1), verwarmingsdeken (2), thermometer (4), condensor (5) en beker (6) gebruikt. echter, de destillatie- of fractioneringskolom (3) is de apparatuur die scheiding op basis van temperatuur mogelijk maakt.
De destillatiekolom heeft een reeks obstakels erin om te voorkomen dat alle componenten van het mengsel tegelijkertijd vervluchtigen.
Dit proces wordt veel gebruikt om fracties van aardolie, een mengsel van koolwaterstoffen, te scheiden. Enkele van de aardoliecomponenten en hun respectievelijke kookpunten (PE) zijn: butaan (PE 20 C), benzine (PE 150 ºC) en kerosine (PE 300 C).
Door gefractioneerde destillatie is butaan de eerste afgescheiden component, omdat het het laagste kookpunt heeft, dan benzine, met een tussenliggend kookpunt, en tenslotte kerosine.
Distillatie toepassingen
Destillatie wordt veel gebruikt in de industrie, omdat veel mengsels dit proces ondergaan. Gedistilleerde dranken zoals whisky, cognac en wodka worden gemaakt met behulp van de methode.
De petrochemische industrie gebruikt gefractioneerde destillatie om olie te raffineren. Destillatietorens zijn grote constructies die gemaakt zijn om de fracties van deze fossiele brandstof te scheiden.

Distillatie-oefeningen
vraag 1
Destillatie is een op eigenschappen gebaseerde scheidingsmethode.
de scheikunde
b) Natuurkunde
c) Biologisch
d) Algemeen van de zaak
Alternatief: b) Natuurkunde.
Het kookpunt is een specifieke fysieke eigenschap van materie, omdat het inherent is aan een bepaalde stof. Het is de temperatuur waarbij een materiaal verandert van een vloeibare in een gasvormige toestand, dat wil zeggen dat het verdampt.
vraag 2
Dit zijn voorbeelden van mengsels gescheiden door destillatie, BEHALVE
a) water + aceton
b) pekel
c) water + olie
d) zeewater
Correct alternatief: c) water + olie.
Water en olie zijn onmengbare stoffen. In dit geval wordt de decantatiemethode gebruikt om de componenten van het mengsel te scheiden. Deze methode is gebaseerd op dichtheidsverschil.
Pekel (water + zout) en zeewater, dat ook opgeloste zouten bevat, worden gescheiden door eenvoudige destillatie. Voor water en aceton wordt gefractioneerde destillatie gebruikt.
vraag 3
(UFRGS) Een bifasisch heterogeen systeem wordt gevormd door drie verschillende vloeistoffen A, B en C. Het is bekend dat:
A en B zijn met elkaar mengbaar;
C is niet mengbaar met A en met B;
A is vluchtiger dan B.
Op basis van deze informatie zijn de meest geschikte methoden voor het scheiden van de drie vloeistoffen:
a) centrifugeren en decanteren.
b) decanteren en fractioneel smelten.
c) filtratie en centrifugatie.
d) filtratie en gefractioneerde destillatie.
e) decanteren en gefractioneerde destillatie.
Correct alternatief: e) decanteren en gefractioneerde destillatie.
Het heterogene systeem van de vraag kent twee fasen:
Fase 1: vloeistoffen A en B, die met elkaar mengbaar zijn
Fase 2: vloeibare C, die niet mengbaar is met de andere componenten
Daarom wordt, vanwege het verschil in dichtheid, fase 1 gescheiden van fase 2 met behulp van de decantatiemethode. Vanwege het verschil in kooktemperatuur, aangezien A vluchtiger is dan B, dat wil zeggen dat het de neiging heeft om gemakkelijk naar de gasvormige toestand over te gaan, wordt gefractioneerde destillatie gebruikt.
Meer kennis opdoen met de inhoud:
- Eenvoudige en gefractioneerde destillatie
- Scheiding van mengsels
- Oefeningen over het scheiden van mengsels