DE isomerie het is een fenomeen dat wordt waargenomen wanneer verschillende verbindingen worden gevormd door gelijke hoeveelheden van dezelfde soorten atomen.
Daarom kunnen we chemische stoffen vinden met dezelfde molecuulformule en verschillende structuurformules of ruimtelijke rangschikkingen.
Dit fenomeen wordt algemeen waargenomen in de organische chemie, die koolstofverbindingen bestudeert. Omdat elk atoom van dit element 4 chemische bindingen kan maken, is het mogelijk om verschillende combinaties waar te nemen.
Omdat de verandering in de rangschikking van atomen aanleiding geeft tot nieuwe stoffen, hebben ze bijgevolg verschillende fysische en chemische eigenschappen.
Als we zeggen welke verbindingen zijn isomeren betekent dat ze gelijke delen hebben, aangezien het woord een combinatie is van twee termen van Griekse oorsprong: isos, betekent "echt", en alleen maar, wat "delen" is.
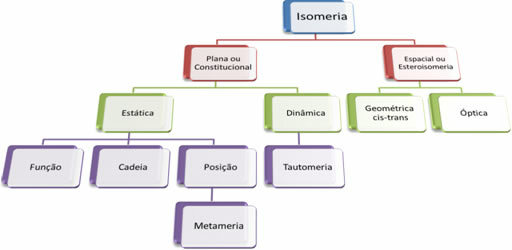
De twee belangrijkste groepen van isomerie zijn vlak en ruimte (stereoisomerie).
DE platte isomerie het kan worden gevisualiseerd door de platte structuurformule van de verbindingen en heeft vijf klassen: positie, functie, keten, compensatie en tautomerie.
DE ruimte isomerie het wordt waargenomen door de oriëntatie van de verbindingen en wordt onderverdeeld in geometrisch (cis-trans) en optisch.
Het concept van isomerie werd in 1830 geïntroduceerd door de Zweedse wetenschapper Jacob Berzelius.
Voorbeelden van isomeren
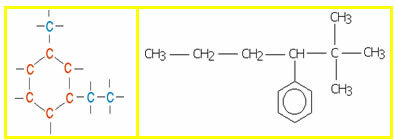
DE keten isomerie het treedt op wanneer dezelfde reeks atomen zich verbinden om structuren van dezelfde functionele groep te vormen, maar met verschillende ketens.
Voorbeeld: de molecuulformule C4H10 van een koolwaterstof kan recht of vertakt zijn.

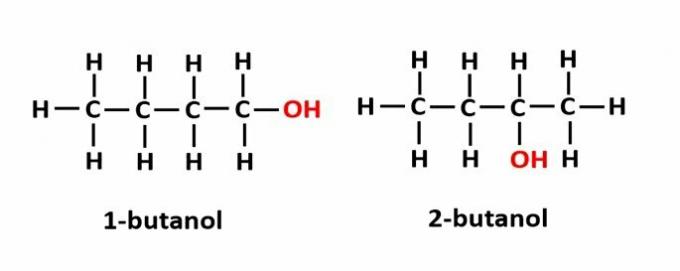
DE positie isomerie treedt op wanneer verbindingen worden gevormd door dezelfde functionele groepen, maar ze bevinden zich op verschillende posities in de keten.
Voorbeeld: De molecuulformule C4H9OH komt overeen met twee soorten alcohol.
DE functie isomerie treedt op wanneer dezelfde molecuulformule overeenkomt met twee verbindingen met verschillende functionele groepen.
Voorbeeld: De molecuulformule C2H6O komt overeen met twee isomeren die de functies alcohol (-OH) en ether (-O-) hebben.
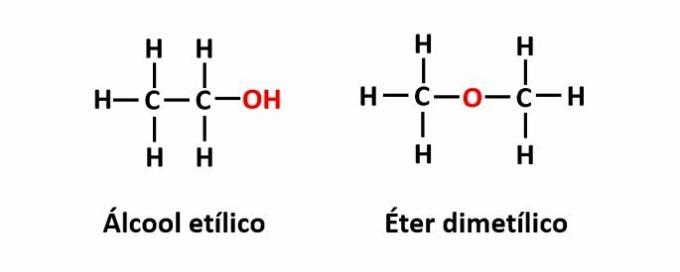
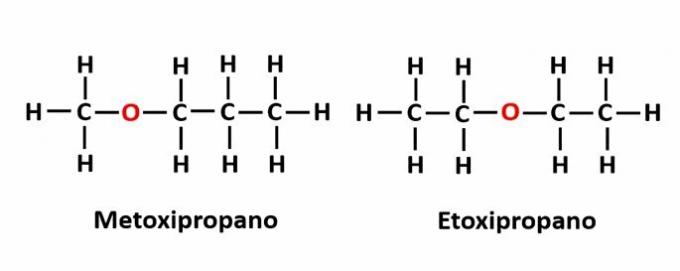
DE compensatie isomerie het komt voor wanneer er een heteroatoom in de keten is en het verschillende posities inneemt. Dit is een bijzonder geval van positie-isomerie.
Voorbeeld: De molecuulformule C4H10De geeft de aanwezigheid van een zuurstofatoom in de keten aan, maar de positie ervan kan veranderen en verschillende verbindingen vormen.
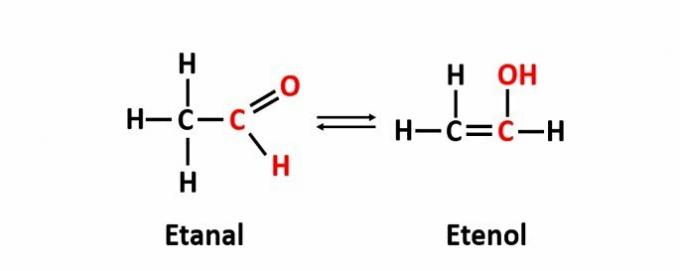
DE dynamische isomerie, ook wel tautomerie genoemd, treedt op wanneer twee verbindingen met verschillende functies in dezelfde oplossing in dynamisch evenwicht zijn. Dit is een bijzonder geval van functie-isomerie.
Voorbeeld: De molecuulformule C2H4O komt overeen met verbindingen met de aldehyde- en enolfuncties.
Leer meer over platte isomerie.
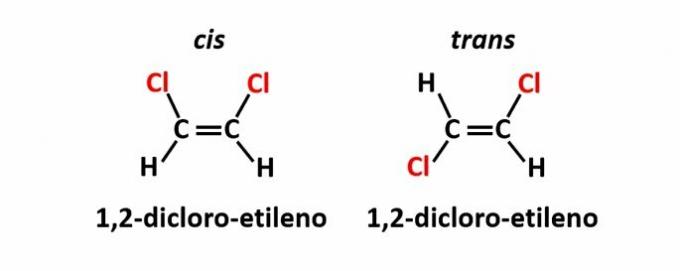
DE geometrische isomerie, ook wel isomerie genoemd cis-trans, treedt op wanneer de aanwezigheid van een dubbele binding of cyclische structuur ervoor zorgt dat gelijke liganden zich aan dezelfde kant van het vlak bevinden (cis) of aan weerszijden (trans).
Voorbeeld: de chlooratomen in verbindingen met molecuulformule C2H2kl2 ze kunnen twee ruimtelijke structuren hebben.
DE optische isomerie treedt op wanneer, bij het afbuigen van het gepolariseerde licht dat op de structuur wordt uitgezonden, de verbindingen erin slagen de straal af te buigen lichtgevend naar links, als het een linksdraaiend (l) isomeer is, of naar rechts, als het een rechtsdraaiend isomeer is (D).
Voorbeeld: Dit type isomerie komt voor bij melkzuur. Merk hieronder op dat de spectrale beelden van de isomeren elkaar niet overlappen, daarom worden ze enantiomeren genoemd.
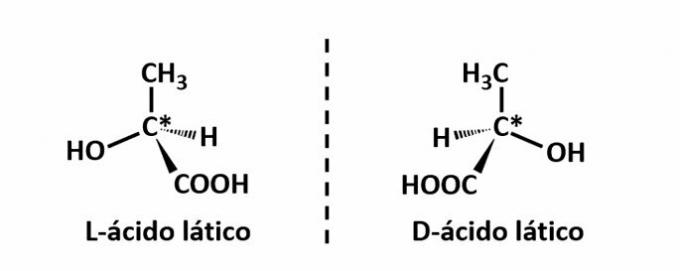
Het symbool C* geeft de aanwezigheid aan van een chiraal koolstofatoom in deze structuur, dwz een koolstofatoom met 4 verschillende linkers.
Leer meer over isomerie met de inhoud:
- Soorten isomerie
- ruimte isomeer
- geometrische isomeer
- optische isomeer
- Oefeningen over vlakke isomerie