Chemische balans is een van de vakken die het meest vallen bij Enem- en toelatingsexamens.
Aspecten van omkeerbare reacties komen aan bod in de vragen en de kandidaten worden beoordeeld zowel door berekeningen als door de concepten die betrekking hebben op dit thema.
Met dat in gedachten hebben we deze lijst met vragen gemaakt met verschillende benaderingen van de chemische balans.
Maak gebruik van de opmerkingen over de resolutie om je voor te bereiden op de examens en bekijk de stapsgewijze instructies voor het oplossen van de vragen.
Algemene concepten van chemisch evenwicht
1. (Uema) In de vergelijking , na het bereiken van chemisch evenwicht, kunnen we de evenwichtsconstante concluderen
, waarover het juist is te stellen dat:
a) hoe hoger de waarde van Kc, hoe lager de opbrengst van de directe reactie.
b) Kç ongeacht de temperatuur.
c) als de snelheden van de voorwaartse en inverse reacties gelijk zijn, dan is Kc = 0.
d) Kç het hangt af van de initiële molariteiten van de reactanten.
e) hoe groter de waarde van Kc, hoe groter de concentratie van de producten.
Juist antwoord: e) hoe groter de waarde van Kc, hoe groter de concentratie van de producten.
De directe reactie wordt weergegeven door het getal 1, waarbij:
De inverse reactie wordt weergegeven door
De waarde van Kç wordt berekend door de verhouding tussen de concentraties van producten en reagentia.
De teller (die de producten bevat) is recht evenredig met de evenwichtsconstante. Daarom, hoe hoger de waarde van Kç, hoe groter de opbrengst van de directe reactie, naarmate er meer product wordt gevormd en, bijgevolg, hoe groter de concentratie van producten.
De waarde van Kç varieert met de temperatuur, omdat wanneer we de waarde ervan veranderen, de endotherme (warmteabsorptie) of exotherme (warmteafgifte) reactie kan zijn begunstigd en hierdoor kan meer reagens of product worden verbruikt of gecreëerd, waardoor de evenwichtsconstante verandert die afhangt van de concentratie van reagentia.
Kc hangt af van de molaire hoeveelheden van de componenten wanneer het evenwicht is bereikt en wanneer de snelheden van de voorwaartse en achterwaartse reacties gelijk zijn.
2. (UFRN) De chemische balans wordt gekenmerkt door een dynamiek op microscopisch niveau. Om kwantitatieve informatie over de mate van chemisch evenwicht te verkrijgen, wordt de evenwichtsconstante hoeveelheid gebruikt. Denk aan de volgende strip:

Toegepast op chemische balans, het idee van balans van het personage:
a) Het is juist omdat, in chemisch evenwicht, de helft van de hoeveelheden altijd producten zijn en de andere helft reactanten.
b) Het is niet correct, omdat in chemisch evenwicht de concentraties van producten en die van reactanten kunnen verschillen, maar ze zijn constant.
c) Het is juist omdat in chemisch evenwicht de concentraties van reactanten en producten altijd hetzelfde zijn, zolang het evenwicht niet wordt verstoord door een extern effect.
d) Het is niet correct, aangezien in chemisch evenwicht de concentraties van de producten altijd hoger zijn dan die van de reactanten, zolang het evenwicht niet wordt beïnvloed door een externe factor.
e) Het is juist omdat, in chemisch evenwicht, de concentraties van reactanten en producten niet altijd hetzelfde zijn.
Juiste antwoord: b) Het is niet juist, omdat in chemisch evenwicht de concentraties van producten en die van reactanten kunnen verschillen, maar ze zijn constant.
Bij evenwicht kunnen de hoeveelheden producten en reagentia worden berekend op basis van de constante van balans, en niet noodzakelijkerwijs de helft van het aantal producten en de andere helft reagentia.
Evenwichtsconcentraties zijn niet altijd hetzelfde, ze kunnen verschillend zijn, maar constant als er geen verstoringen in het evenwicht optreden.
Evenwichtsconcentraties moeten afhangen van welke reactie de voorkeur heeft, direct of omgekeerd. We kunnen dit weten door de waarde van Kç: als Kç 1, Directe reactie heeft de voorkeur. al als Kç
1 de omgekeerde reactie heeft de voorkeur.
Chemische balansgrafieken
3. (UFPE) Aan het begin van de 20e eeuw zorgde de verwachting van de Eerste Wereldoorlog voor een grote behoefte aan stikstofverbindingen. Haber was een pionier in de productie van ammoniak uit stikstof in de lucht. Als ammoniak in een gesloten container wordt geplaatst, ontleedt het volgens de volgende ongebalanceerde chemische vergelijking: NH3(g) → Nee2(g) + H2(g). De variaties in concentraties in de tijd worden geïllustreerd in de volgende afbeelding:

Uit de analyse van de bovenstaande figuur kunnen we stellen dat de curven A, B en C de temporele variatie van de concentraties van respectievelijk de volgende reactiecomponenten vertegenwoordigen:
Ah2, Nee2 en NH3
b) NH3, H2 en nee2
c) NH3, Nee2 en H2
d) Nee2, H2 en NH3
e) H2, NH3 en nee2
Juiste antwoord: d) Nee2, H2 en NH3.
1e stap: breng de chemische vergelijking in evenwicht.
2 NH3(g) → Nee2(g) + 3 H2(g)
Met de uitgebalanceerde reactie realiseerden we ons dat er 2 mol ammoniak nodig is om te ontleden in stikstof en waterstof. Ook is de hoeveelheid waterstof die bij de reactie wordt geproduceerd driemaal groter dan die van ammoniak.
2e stap: interpreteer de kaartgegevens.
Als ammoniak wordt afgebroken, is de concentratie in de grafiek maximaal en neemt af, zoals te zien is in curve C.
De producten, zoals ze worden gevormd, aan het begin van de reactie zijn de concentraties nul en nemen toe naarmate de reactant een product wordt.
Aangezien de geproduceerde hoeveelheid waterstof drie keer groter is dan die van stikstof, is de curve voor dit gas het grootst, zoals opgemerkt in B.
Het andere product dat wordt gevormd is stikstof, zoals te zien is in curve A.
4. (Cesgranrio) Het systeem weergegeven door de vergelijking in evenwicht was. De evenwichtstoestand werd abrupt veranderd door een toevoeging van stof G. Het systeem reageert om het evenwicht te herstellen. Welke van de volgende grafieken geeft het beste de veranderingen weer die zich hebben voorgedaan tijdens het beschreven proces?
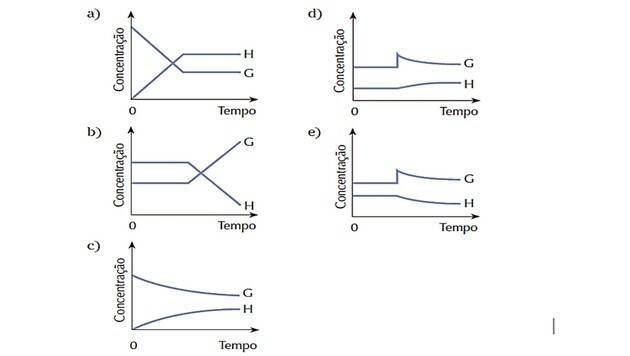
Juiste antwoord: d).

Omdat het systeem in het begin in evenwicht was, bleven de hoeveelheden van de stoffen G en H constant.
De verstoring trad op toen de concentratie van G toenam en het systeem reageerde door dit te transformeren reactant in meer product H, de balans naar rechts verschuivend, dat wil zeggen de reactie begunstigen direct.
We zien dat de reagenscurve G afneemt naarmate deze wordt verbruikt, en de productcurve H toeneemt naarmate deze wordt gevormd.
Wanneer een nieuw evenwicht is bereikt, worden de hoeveelheden weer constant.
Evenwichtsconstante: relatie tussen concentratie en druk
5. (UFRN) Wetende dat KP = Kç (RT)nee, kunnen we zeggen dat KP = Kç, voor:
staal2(g) + H2(g) CO(g) + H2O(g)
b) H2(g) + de2(g) H2O(1)
c) Nee2(g) + 3 H2(g) ↔ 2 NH3(g)
d) NEE(g) + O2(g) NEE2(g)
e) 4 FeS(en) + 7 O2(g) ↔ 2 Fe2O3(en) + 4 SO2(g)
Correct antwoord: a) CO2(g) + H2(g) CO(g) + H2O(g)
naar KP gelijk zijn aan Kç de variatie in het aantal moedervlekken moet gelijk zijn aan nul, aangezien elk getal dat tot nul wordt verhoogd resulteert in 1:
KP = Kç (RT)0
KP = Kç x 1
KP = Kç
De verandering in het aantal moedervlekken wordt berekend door:
∆n = Aantal mol producten - Aantal mol reagentia
In deze berekening doen alleen de coëfficiënten van stoffen in gasvormige toestand mee.
Toepassen op elke alternatieve vergelijking, hebben we:
| staal2(g) + H2(g) CO(g) + H2O(g) | ∆n = [(1+1) - (1+1)] = 2 - 2 = 0 |
| b) H2(g) + de2(g) H2O(1) | ∆n = [0 - (1+1/2)] = 0 - 3/2 = - 3/2 |
| c) Nee2(g) + 3 H2(g) ↔ 2 NH3(g) | ∆n = [2 - (1+3)] = 2 - 4 = - 2 |
| d) NEE(g) + de2(g) NEE2(g) | ∆n = [1 - (1+1/2)] = 1 - 3/2 = - 1/2 |
| e) 4 FeS(en) + 7 O2(g) ↔ 2 Fe2O3(en) + 4 SO2(g) | ∆n = [(0+4) - (0+7)] = 4 - 7 = - 3 |
Met deze resultaten kunnen we zien dat het alternatief waarvan de waarde overeenkomt met het vereiste resultaat, het alternatief is in de eerste vergelijking.
6. (UEL-aangepast) Voor de reactie weergegeven door de evenwichtsconstanten Kç en KP worden uitgedrukt door de vergelijkingen: (Gegeven: p = partiële druk)
Correct alternatief:
De evenwichtsconstante wordt berekend door:
Vaste verbindingen nemen vanwege hun constante concentraties niet deel aan de berekening van Kç, daarom is de evenwichtsconstante voor de gegeven vergelijking:
Voor de evenwichtsconstante, in termen van druk, nemen alleen de gassen deel aan de berekening, dus:
Berekening van de evenwichtsconstante
7. (Enem/2015) Verschillende zuren worden gebruikt in industrieën die hun afvalwater afvoeren in waterlichamen, zoals rivieren en meren, wat de milieubalans kan beïnvloeden. Om de zuurgraad te neutraliseren, kan calciumcarbonaatzout in geschikte hoeveelheden aan het effluent worden toegevoegd, aangezien het bicarbonaat produceert, dat het water neutraliseert. De vergelijkingen die bij het proces betrokken zijn, worden gepresenteerd:
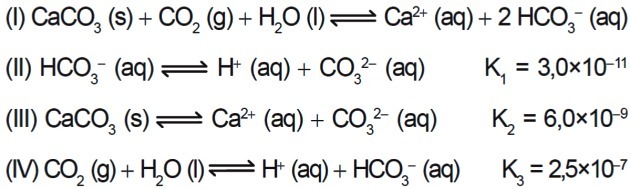
Op basis van de waarden van de evenwichtsconstanten van reacties II, III en IV bij 25°C, wat is de numerieke waarde van de evenwichtsconstante van reactie I?
a) 4,5 x 10-26
b) 5,0 x 10-5
c) 0,8 x 10-9
d) 0,2 x 105
e) 2,2 x 1026
Correct antwoord: b) 5,0 x 10-5
1e stap: gebruik de wet van Hess om de nodige aanpassingen te maken.
Gegeven een chemische vergelijking:
De constante wordt berekend door:
Maar als we de vergelijking omkeren, krijgen we als resultaat:
En de constante wordt de inverse:
Om tot vergelijking 1 in de vraag te komen, moeten we vergelijking II omkeren, zoals in het vorige voorbeeld.
2e stap: Manipuleer vergelijkingen II, III en IV om tot het resultaat van vergelijking I te komen.
3e stap: bereken de evenwichtsconstante van vergelijking I.
K. berekenenik wordt gedaan door de constante waarden te vermenigvuldigen.
Omdat we in de berekening gelijke machten van basen hebben, herhalen we het grondtal en tellen we de exponenten op.
Omdat we nu een deling hebben met gelijke machten van grondtalen, herhalen we het grondtal en trekken we de exponenten af.
8. (UnB) Fosforpentachloride is een zeer belangrijk reagens in de organische chemie. Het wordt bereid in de gasfase door de reactie:
Een fles met een inhoud van 3,00 L bevat bij evenwicht, bij 200 °C: 0,120 mol PCl5(g), 0,600 mol PCl3(g) en 0,0120 mol CL2(g). Wat is de waarde van de evenwichtsconstante bij deze temperatuur?
Correct antwoord: 50 (mol/L)-1
1e stap: Stel de uitdrukking van de evenwichtsconstante voor de reactie samen.
2e stap: bereken de concentraties in mol/L van elke component bij evenwicht.
Molaire concentratie formule:
| PCl3 | kl2 | PCl5 |
3e stap: vervang de concentraties in de constante uitdrukking en bereken de waarde van Kç.
Aanvragen voor evenwichtsevenwicht
9. (Enem/2016) Na volledige slijtage kunnen de banden worden verbrand om energie op te wekken. Van de gassen die vrijkomen bij de volledige verbranding van gevulkaniseerd rubber, zijn sommige verontreinigende stoffen die zure regen veroorzaken. Om te voorkomen dat ze in de atmosfeer terechtkomen, kunnen deze gassen worden geborreld in een waterige oplossing die een geschikte stof bevat. Houd rekening met de stofinformatie in de tabel.
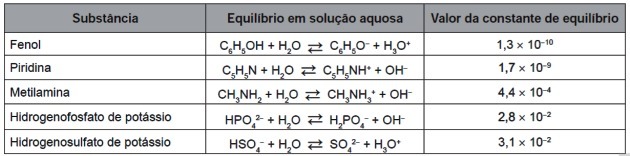
Van de in de tabel vermelde stoffen is de stof die vervuilende gassen het meest efficiënt kan verwijderen (a)
a) Fenol.
b) Pyridine.
c) Methylamine.
d) Kaliumwaterstoffosfaat.
e) Kaliumwaterstofsulfaat.
Juiste antwoord: d) Kaliumwaterstoffosfaat.
de CO2, zwaveloxiden (SO2 en dus3) en stikstofoxiden (NO en NO2) zijn de belangrijkste vervuilende gassen.
Wanneer ze reageren met water dat in de atmosfeer aanwezig is, is er een zuurvorming die een verhoging van de zuurgraad van de regen veroorzaken, daarom wordt het zure regen genoemd.
De evenwichtsconstanten in de tabel worden als volgt berekend door de verhouding tussen de concentraties van producten en reagentia:
Merk op dat de evenwichtsconstante evenredig is met de concentratie van producten: hoe groter de hoeveelheid producten, hoe groter de waarde van Kç.
Let op de waarden van de eerste en laatste composiet in de tabel voor Kç:
| pyridine | ||
| Kaliumwaterstofsulfaat |
Als we de twee getallen vergelijken, zien we dat hoe kleiner de negatieve macht, hoe groter de waarde van de constante.
Om verontreinigende stoffen efficiënter te verwijderen, OH- reageren met H-ionen+ aanwezig in zuren via a neutralisatie-reactie.
Onder de gepresenteerde stoffen zijn die die de hydroxylen produceren die nodig zijn om zure verbindingen te neutraliseren: pyridine, methylamine en kaliumwaterstoffosfaat.
Om erachter te komen welke verbinding het meest efficiënt is, observeren we de evenwichtsconstanten: hoe hoger de constante, hoe groter de concentratie van OH-.
De waterige oplossing die een voor dit doel geschikte stof bevat, is dus kaliumwaterstoffosfaat, omdat het basisch is en zuren efficiënter neutraliseert.
Lees deze teksten voor meer informatie.:
- ionische balans
- Neutralisatie-reactie
10. (Enem/2009) Zepen zijn zouten van carbonzuren met een lange keten die worden gebruikt om tijdens wasprocessen, het verwijderen van stoffen die slecht in water oplosbaar zijn, bijv. oliën en vetten. De volgende figuur geeft de structuur van een zeepmolecuul weer.
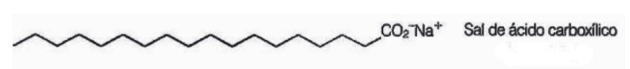
In oplossing kunnen zeepanionen water hydrolyseren en daardoor het overeenkomstige carbonzuur vormen. Voor natriumstearaat wordt bijvoorbeeld de volgende balans vastgesteld:
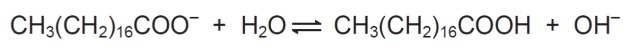
Omdat het gevormde carbonzuur slecht oplosbaar is in water en minder efficiënt is in het verwijderen van vetten, de pH van het medium moet zo worden geregeld dat de bovenstaande balans niet naar rechts verschuift.
Op basis van de informatie in de tekst is het juist om te concluderen dat zepen op een bepaalde manier werken:
a) Efficiënter bij basische pH.
b) Efficiënter bij zure pH.
c) Efficiënter bij neutrale pH.
d) Efficiënt over elk pH-bereik.
e) Efficiënter bij zure of neutrale pH.
Antwoord: a) Efficiënter bij basische pH.
In de getoonde balans zien we dat natriumstearaat bij reactie met water een carbonzuur en hydroxyl vormt.
Het doel van het regelen van de pH is om de vorming van carbonzuur niet toe te staan, en dit wordt gedaan door de balans te verschuiven door de OH-concentratie te veranderen-.
hoe meer OH- in oplossing is er een verstoring aan de productzijde en reageert het chemische systeem door de stof te consumeren waarvan de concentratie is verhoogd, in dit geval de hydroxyl.
Bijgevolg zal er de omzetting van producten in reagentia plaatsvinden.
Daarom werken zepen het meest efficiënt bij een basische pH, aangezien een teveel aan hydroxyl de balans naar links verschuift.
Als de pH zuur zou zijn, zou er een hogere concentratie H. zijn+ dat zou de balans beïnvloeden door OH. te consumeren- en de balans zou werken door meer hydroxyl te produceren, de balans naar links te verschuiven en meer carbonzuur te produceren, wat niet van belang is in het gepresenteerde proces.
Chemische evenwichtsverschuiving
11. (Enem/2011) Frisdranken worden steeds vaker het doelwit van het volksgezondheidsbeleid. Lijmproducten bevatten fosforzuur, een stof die schadelijk is voor de fixatie van calcium, het mineraal dat het hoofdbestanddeel is van de tandmatrix. Cariës is een dynamisch proces van onbalans in het proces van tandheelkundige demineralisatie, verlies van mineralen door zuurgraad. Het is bekend dat het hoofdbestanddeel van tandglazuur een zout is dat hydroxyapatiet wordt genoemd. De soda verlaagt door de aanwezigheid van sucrose de pH van de biofilm (bacteriële plaque), waardoor het tandglazuur wordt gedemineraliseerd. Speekselafweermechanismen hebben 20 tot 30 minuten nodig om de pH-waarde te normaliseren en de tand te remineraliseren. De volgende chemische vergelijking geeft dit proces weer:
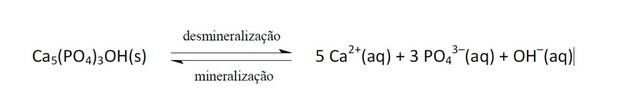 GROISMAN, S. De impact van frisdrank op tanden wordt beoordeeld zonder het uit het dieet te halen. Beschikbaar in: http://www.isaude.net. Betreden op: 1 mei 2010 (aangepast).
GROISMAN, S. De impact van frisdrank op tanden wordt beoordeeld zonder het uit het dieet te halen. Beschikbaar in: http://www.isaude.net. Betreden op: 1 mei 2010 (aangepast).
Aangezien een persoon dagelijks frisdranken consumeert, kan een proces van tanddemineralisatie optreden als gevolg van de verhoogde concentratie van
a) OH–, die reageert met Ca-ionen2+, verschuivende balans naar rechts.
b) H+, die reageert met de OH-hydroxylen–, verschuivende balans naar rechts.
c) OH–, die reageert met Ca-ionen2+, balans naar links verschuivend.
d) H+, die reageert met de OH-hydroxylen–, balans naar links verschuivend.
e) Ca2+, die reageert met de OH-hydroxylen–, balans naar links verschuivend.
Correct antwoord: b) H+, die reageert met de OH-hydroxylen–, verschuivende balans naar rechts.
Wanneer de pH daalt, is dat omdat de zuurgraad is toegenomen, dat wil zeggen, de concentratie van H-ionen+, zoals de verklaring zegt, is er de aanwezigheid van fosforzuur.
Deze ionen reageren met OH- waardoor deze stof wordt geconsumeerd en bijgevolg de balans naar rechts verschuift, omdat het systeem werkt door meer van deze verwijderde ionen te produceren.
De evenwichtsverschuiving tussen reactanten en producten trad op als gevolg van de afname van de OH-concentratie-.
Als de Ca-ionen2+ en oh- als de concentratie was toegenomen, zou de balans naar links verschuiven, omdat het systeem zou reageren door ze te consumeren en meer hydroxyapatiet te vormen.
Het wijzigen van de vorige balans, gerelateerd aan koudemiddellekkage onder de beschreven omstandigheden, resulteert in:
a) CO-afgifte2 voor het milieu.
b) Het verhogen van de temperatuur van de container.
c) Verhoging van de interne druk van de container.
d) Verhoging van de CO-concentratie2 in de vloeistof.
e) Vorming van een aanzienlijke hoeveelheid H2O.
Correct antwoord: a) CO-uitstoot2 voor het milieu.
In de fles was de kooldioxide door hoge druk opgelost in de vloeistof.
Wanneer de fles wordt geopend, is de druk in de container (die groter was) gelijk aan de druk in de omgeving en daarmee ontsnapt er koolstofdioxide.
De evenwichtsverschuiving tussen reactanten en producten vond plaats door de afname van de druk: wanneer de druk afneemt, verschuift het evenwicht naar het grootste volume (aantal mol).
De reactie verschoof naar links en de CO2 die in de vloeistof was opgelost, kwam vrij en lekte eruit toen de fles werd geopend.



