Anorganische chemie is de tak van de chemie die niet-koolstofverbindingen bestudeert. Dat komt omdat die gemaakt van koolstof worden bestudeerd door organische chemie.
Aanvankelijk werd anorganische chemie gedefinieerd als het deel van de chemie dat minerale verbindingen bestudeerde. Om deze reden werd het ook wel minerale chemie genoemd.
Ondertussen was de studie van de organische chemie gericht op verbindingen van plantaardige en dierlijke oorsprong.
Het belangrijkste kenmerk van anorganische verbindingen is de afwezigheid van koolstof in hun samenstelling. Bovendien hebben de meeste van deze verbindingen als fysische eigenschap dat ze vast zijn. Als chemische eigenschap valt het feit op dat ze ionisch zijn, wat betekent dat ze elektronen winnen of verliezen.
Anorganische functies
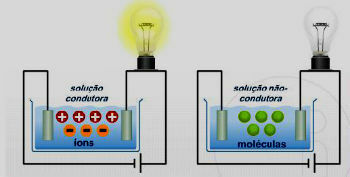
Het was Arrhenius die de groepering van anorganische verbindingen voorstelde. Dit gebeurde op basis van de ontdekking van componenten die oplossen in water en uiteenvallen in geëlektrificeerde deeltjes, de ionen.
Uit de theorie van Arrhenius (1887) werden de anorganische verbindingen gegroepeerd volgens de overeenkomst die er tussen bestond. Dit vergemakkelijkte de studie van de anorganische chemie.
De belangrijkste anorganische functies zijn zuren, basen, zouten en oxiden.
Zuren zijn verbindingen die reageren met basen en zouten en water vormen (neutralisatie). Ze hebben een zure smaak, pH lager dan 7 en in waterige oplossing ioniseren ze en ontstaan, met een van de ionen, het H-kation+.
Enkele voorbeelden van zuren: Zwavelzuur (H2ENKEL EN ALLEEN4), zoutzuur (HCN), fluorwaterstofzuur (HF).
In tegenstelling tot zuren zijn basen stoffen met een pH hoger dan 7 en een samentrekkende, bittere smaak. In waterige oplossing ondergaat het de zogenaamde "ionische dissociatie", omdat het het OH-anion vrijgeeft- (Hydroxide).
Enkele voorbeelden van basen: Natriumhydroxide (NaOH), Magnesiumhydroxide (Mg (OH)2), Kaliumhydroxide (KOH).
Zouten zijn ionische verbindingen met een zoute smaak die reageren met zouten, zuren, hydroxiden en metalen om andere zouten te vormen.
Enkele voorbeelden van zouten: Natriumchloride (NaCl), Natriumbicarbonaat (NaHCO3), Natriumnitraat (NaNO3).
Oxiden zijn binaire verbindingen waarin zuurstof (O) is ingedeeld in: zuur- of anhydrideoxiden, basische oxiden en peroxiden.
Enkele voorbeelden van oxiden: Calciumoxide (CaO), Koolmonoxide (CO), Zwaveldioxide (SO2).
Lees meer over elk van deze functies op Anorganische functies.
In oefeningen op anorganische functies je kunt je kennis ook testen met toelatingsexamenvragen!
Nu je weet wat anorganische chemie is, lees ook:
- Arrhenius-theorie
- Organische chemie
- Zuur-base indicatoren