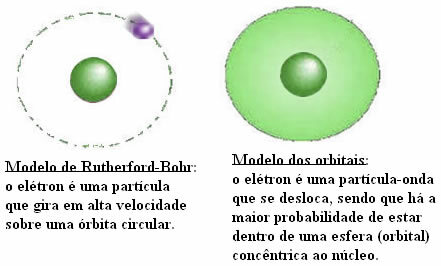
Ionische dissociatie is de scheiding van ionen die optreedt van ionische verbindingen opgelost in water.
Water interageert met ionen en veroorzaakt hun scheiding, een fenomeen dat solvatatie wordt genoemd.
Het dissociatieproces werd ontdekt door de natuurkundige-chemicus Svant August Arrhenius (1859-1927).
Hij merkte op dat sommige stoffen, wanneer ze in water worden geplaatst, elektriciteit kunnen geleiden. Zo suggereerde Arrhenius dat er in waterige oplossingen elektrisch geladen deeltjes moeten zijn, de ionen.
Het is belangrijk om te benadrukken dat alleen ionische stoffen, zoals zouten en basen, dissociatie ondergaan in oplossingen of smelten.
Werkwijze
Om het dissociatieproces te illustreren, kunnen we NaCl, tafelzout, gebruiken.
Wanneer NaCl in water wordt geplaatst, hebben we de volgende vergelijking:
NaCl is een ionische verbinding, dus de ionen bestonden al, wat alleen gebeurde was de scheiding tussen hen door de werking van water.
Nu hebben we nog een voorbeeld met een basis:
De NaOH, een base, wanneer geplaatst in water, de binding tussen de Na
+ en oh- is gebroken en ze komen in het midden vrij.Onthoud dat basen stoffen zijn die hydroxylionen afgeven (OH-anionen)–) in waterige oplossing.
Andere voorbeelden van ionische dissociatie in basen:
1)
2)
Belangrijk is dat vrije ionen in waterige oplossingen elektriciteit kunnen geleiden.
Lees ook:
- zouten
- basissen
- Neutralisatie-reactie
Dissociatie en ionisatie
Begrijp het verschil tussen ionische dissociatie en ionisatie:
- ionische dissociatie: Het is het fysieke proces van scheiding van ionen dat plaatsvindt in zouten en basen.
- ionisatie: Het is een chemische reactie waarbij ionen ontstaan uit zuren die in water zijn geplaatst.
Ionisatie is dus het proces van ionenvorming. Voorbeeld:
In het geval van HCl (zoutzuur) wordt de chemische binding tussen H en Cl verbroken en worden H-ionen gevormd+ en Cl-.
In het algemeen kunnen bij dissociatie en ionisatie vrije elektronen elektriciteit geleiden.

Deze situatie doet zich bijvoorbeeld niet voor bij suiker (C12H22O11) die geen ionen vormt in een waterige oplossing.
Er is dus geen stroomgeleiding en suiker lost alleen op in water.
Meer weten, ook lezen:
- ion, kation en anion
- ionische balans
- Chemische bindingen
- Fysische en chemische transformaties
Zorg ervoor dat u toelatingsexamenvragen over het onderwerp, met een becommentarieerde resolutie, bekijkt in: oefeningen op anorganische functies.