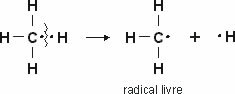
De polariteit van moleculen is een zeer belangrijk aspect, aangezien de eigenschappen van stoffen onder meer worden bepaald door het feit dat hun moleculen polair of niet-polair zijn.
De bepaling van de polariteit van een molecuul kan worden uitgevoerd met behulp van de Dipoolmoment of Resulterend dipoolmoment, wiens symbool is 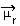 . Als we het alleen hebben over het dipoolmoment van elke binding in het molecuul, dan is het symbool de Griekse letter mi (µ).
. Als we het alleen hebben over het dipoolmoment van elke binding in het molecuul, dan is het symbool de Griekse letter mi (µ).

Het molecuul zal niet-polair zijn als het dipoolmoment gelijk is aan nul, maar als het niet-nul is, betekent dit dat het polair is.

Er zijn twee belangrijke dingen waarmee rekening moet worden gehouden bij het bepalen van dit resulterende dipoolmoment. Laten we eens kijken wat ze zijn:
1) elektronegativiteitsverschil tussen de atomen van de elementen die aan de reactie deelnemen. Het HF-molecuul heeft bijvoorbeeld een duidelijk verschil in elektronegativiteit, omdat fluor, veel meer dan waterstof, het elektronenpaar in de binding aantrekt. De verdeling van ladingen is dus niet symmetrisch, met elektrische dipolen.
Deze dipool wordt weergegeven door een vector die naar het uiteinde is gericht dat de meeste elektronen concentreert, dat wil zeggen van het minste tot het meest elektronegatieve atoom. Dus in dit geval zal de vector, die de enige is, de resulterende vector zijn, zoals hieronder aangegeven:
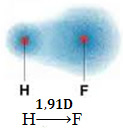
Merk op dat de vectorwaarde hetzelfde is als het dipoolmoment, dat wordt gegeven in debye-eenheid (D=3.33. 10-30 coulomb. metro). Aangezien het dipoolmoment niet nul is, zijn het molecuul en de binding polair.
Niet stoppen nu... Er is meer na de reclame ;)
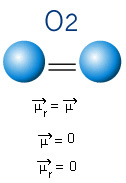
In het onderstaande molecuul hebben we ook een molecuul met slechts twee atomen, maar in dit geval komt het overeen met een eenvoudige stof, dat wil zeggen dat het uit slechts één type element bestaat. Daarom is er geen verschil in elektronegativiteit; atomen trekken ook elektronen aan, die symmetrisch zijn verdeeld. Het resulterende dipoolmoment is gelijk aan nul, dus zowel de binding als het molecuul zijn apolair.
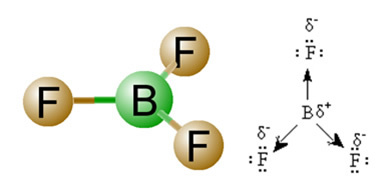
2) Molecuul Geometrie, dat wil zeggen, de ruimtelijke rangschikking van de vectoren. Het BF-molecuul3 het heeft drie polaire bindingen, waarbij fluor het meest elektronegatief is, waardoor de vectoren erop gericht zijn. Omdat de ruimtelijke rangschikking van de atomen echter plat trigonaal is, zorgt dit ervoor dat de elektronen een symmetrische verdeling rond het centrale atoom hebben. Het resultaat is dus dat deze drie vectoren elkaar opheffen en het dipoolmoment gelijk is aan nul. Daarom is het BF-molecuul3 é verontschuldigen.
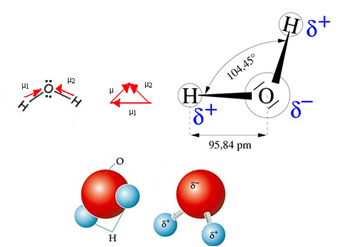
Het watermolecuul heeft twee vectoren, maar de ruimtelijke geometrie is niet plat, maar in de vorm van een V. Merk op in de volgende afbeelding dat op deze manier hun vectoren elkaar niet opheffen, de elektronen asymmetrisch zijn verdeeld en meer geconcentreerd in het meest elektronegatieve atoom, dat zuurstof is. Het dipoolmoment is dus anders dan nul en het watermolecuul is polair:
Door Jennifer Fogaça
Afgestudeerd in scheikunde