De tekst Titratie toonde hoe deze volumetrische analysetechniek wordt uitgevoerd, waarvan het hoofddoel is: identificeer de concentratie van een oplossing door zijn reactie met een andere oplossing met bekende concentratie.
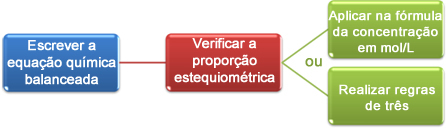
Nu zullen we zien hoe we de bij de titratie verkregen gegevens kunnen gebruiken om tot de gewenste concentratie te komen, die een zuur of een base in oplossing kan zijn. Om dit te doen, zijn er in principe drie stappen:
Laten we een voorbeeld bekijken:
Laten we zeggen dat een scheikundige een oplossing van azijnzuur (azijn (CH3COOH(hier))) en wilde de concentratie in mol/L weten. Vervolgens deed hij 20,0 ml azijn (getitreerd) in een erlenmeyer en voegde de fenolftaleïne-indicator toe. Daarna vulde hij een buret van 100 ml met natriumhydroxide (NaOH) met een bekende concentratie (titrant) gelijk aan 1,0 mol/L. Ten slotte voerde de chemicus de titratie uit en merkte op dat de kleurverandering (keerpunt - toen hij de titratie stopte) optrad toen 24 ml NaOH werd verbruikt.

Op basis van dit experiment verkreeg hij de volgende gegevens:
MCH3COOH= ?
VCH3COOH = 20 ml = 0,02 L
MNaOH = 24 ml = 0,024 L
VNaOH = 1,0 mol/L
Waarbij M = concentratie in mol/L en V = volume in L.
Om de concentratie van azijnzuur te achterhalen, moeten we eerst weten hoe we de chemische vergelijking moeten schrijven die de goed uitgebalanceerde neutralisatiereactie weergeeft die heeft plaatsgevonden. In dit geval is de reactie als volgt:
1 CH3COOH(hier) + 1 NaOH(hier) → 1 NaC2H3O2(aq) + 1 uur2O(ℓ)
Dit deel is belangrijk om de stoichiometrische verhouding te zien waarmee de reactanten reageren. Merk op dat de verhouding 1: 1 is, dat wil zeggen dat voor elke mol azijnzuur 1 mol natriumhydroxide nodig is.
Nu kunnen we op twee manieren verder gaan met de berekeningen:
(1) Via de formule: M1. V1 = M2. V2
Aangezien de stoichiometrische verhouding 1:1 is, moeten we: NeeCH3COOH = neeNaOH .
Niet stoppen nu... Er is meer na de reclame ;)
Wezen M = n/V → n = M. V. Zo komen we tot de bovenstaande lijst, die in dit geval als volgt kan worden geschreven: MCH3COOH. CH3COOH = MNaOH. VNaOH
Vervang dus gewoon de waarden van deze formule:
MCH3COOH. V CH3COOH = MNaOH. VNaOH
MCH3COOH. 0,02 L = 1,0 mol/L. 0,024 L
MCH3COOH = 0,024 mol
0,02 L
MCH3COOH = 1,2 mol/L
Daarom was de beginconcentratie van de azijnzuuroplossing, onze titel, 1,2 mol/L.
Belangrijke notitie: Als de stoichiometrische verhouding niet 1:1 zou zijn, zou het voldoende zijn om de concentratie in mol/L (M) van de stoffen te vermenigvuldigen met hun respectievelijke coëfficiënten. Als de verhouding bijvoorbeeld 1: 2 was, zouden we het volgende hebben:
M1. V1 = 2. M2. V2
Maar hier is een andere manier om deze berekeningen uit te voeren:
(2e) Door regels van drie:
1 CH3COOH(hier) + 1 NaOH(hier) → 1 CH3COONa(hier) + 1 uur2O(ℓ)
1 mol 1 mol 1 mol 1 mol
1. 60 gram 1. 40 gram 1. 82 gram 1. 18 gram
Deze massa's zijn de berekende molecuulmassa's voor elke stof.
* Wetende dat het verbruikte volume van de 1,0 mol/L NaOH-oplossing(hier) 24 ml was, kunnen we eerst de hoeveelheid stof (mol) NaOH achterhalen die reageerde:
1 mol NaOH → 1,0 L
1 mol NaOH 1000 ml
x 24 ml
x = 0,024 mol NaOH
* Aangezien de verhouding 1:1 is, moet de hoeveelheid stof (mol) van azijnzuur gelijk zijn aan NaOH: 0,024 mol.
observatie: Als de stoichiometrische verhouding anders zou zijn, dan zouden we daar in dit deel rekening mee houden. Als het bijvoorbeeld 1:3 was en de hoeveelheid materie van één chemisch reactieve soort gelijk was aan 0,024 mol, dan zou die van de andere stof drievoudig zijn: 0,072.
* Nu berekenen we:
20 ml azijn 0,024 mol azijnzuur
1000 ml azijn en
y = 1,2 mol
Dat wil zeggen, er is 1,2 mol/L, wat dezelfde waarde is als bij de vorige methode.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
