O Thomson atoommodel werd in het jaar 1898 voorgesteld door de Engelse natuurkundige Joseph John Thomson of, eenvoudigweg, J.J. Thomson. Na meerdere experimenteel bewijs voor het bestaan van het elektron, verwierp hij de theorie van de ondeelbaarheid van het atoom voorgesteld door John Dalton.
Thomson bevestigde en bewees op basis van zijn model het bestaan van elektronen (deeltjes met een negatieve elektrische lading) in het atoom, dat wil zeggen, het atoom heeft subatomaire deeltjes.
Mindmap: Thomson Atomic Model
* Om de mindmap in PDF te downloaden, Klik hier!
Thomson stelde zijn atoommodel voor gebaseerd op ontdekkingen met betrekking tot radioactiviteit en experimenten uitgevoerd met de kathodestraalbuis gebouwd door wetenschappers Geissler en Crookes. Zie een weergave van deze buis:
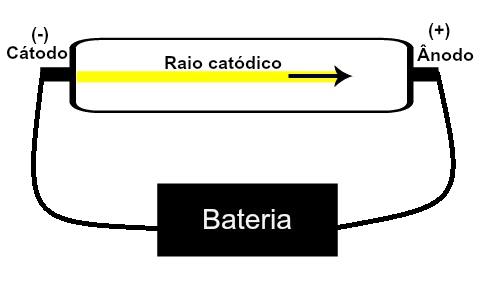
Wanneer een ijl gas onder lage druk wordt blootgesteld aan een hoge elektrische spanning (bijv. 15.000 V), produceert het een lichtstraal (samengesteld uit elektrische ladingen) van de kathode (negatieve pool) naar de anode (pool positief).
Met dit experiment kwam Thomson tot de conclusie dat wanneer de atomen van het gasvormige materiaal binnenin... van de buis werden onderworpen aan een hoge spanning, hun elektronen werden eruit gerukt en naar de plaat geleid positief.
Overwegingen voorgesteld door het Thomson-atoommodelson
Met de experimenten die met de kathodestraalbuis werden uitgevoerd, stelde Thomson zijn interpretatie voor van hoe het atoom en zijn samenstelling eruit zouden zien. Dus volgens hem:
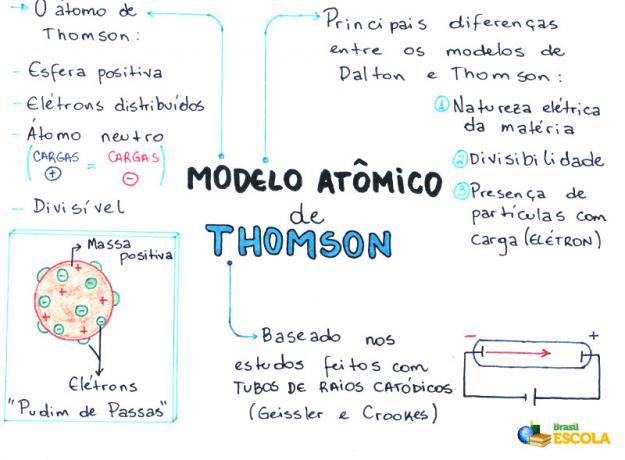
- Het atoom is een bol, maar niet massief zoals voorgesteld door de John Dalton atoommodelton;
- Het atoom is neutraal, aangezien alle materie neutraal is;
- Omdat het atoom elektronen heeft, die negatieve ladingen hebben, moet het daarom positieve deeltjes hebben, zodat de uiteindelijke lading nul is;
- Elektronen zijn niet gefixeerd of opgesloten in het atoom, ze kunnen onder bepaalde omstandigheden worden overgedragen naar een ander atoom;
- Het atoom kan worden beschouwd als een continue vloeistof met positieve ladingen waar elektronen, die een negatieve lading hebben, zouden worden verdeeld;
- gekoppeld aan uw model naar een rozijnenpudding (die de elektronen vertegenwoordigen);
- Omdat de elektronen die worden verstrooid dezelfde lading hebben, is er een onderlinge afstoting tussen hen, waardoor ze gelijkmatig over de bol zijn verdeeld.
Nieuwigheden voorgesteld aan het atoom door het Thomson-model
Thomson's atomaire model was de tweede voorgesteld voor het atoom. Het eerste model werd geformuleerd door John Dalton.
Niet stoppen nu... Er is meer na de reclame ;)
Het model van Thomson ging over nieuwe kennis over het atoom die tot dan toe niet was voorgesteld bij gebrek aan wetenschappelijke basis, zoals:
- Elektrische aard van materie;
- Atoom splitsbaarheid;
- Aanwezigheid van kleine, geladen deeltjes in het atoom.
Problemen gewezen op het Thomson-atoom
Verschillende natuurkundigen ten tijde van het voorstel van de Thomson atoommodel, gebaseerd op de theorieën van de klassieke fysica, wees op enkele inconsistenties in dit model:
- Thomson stelde voor dat het atoom een stabiliteit had met betrekking tot de uniforme verdeling van elektronen, die door de invloed van energie zou kunnen worden gewijzigd. Klassieke natuurkunde, gebaseerd op elektromagnetisme, staat niet toe dat er een stabiel systeem bestaat dat alleen is gebaseerd op de afstoting tussen deeltjes met dezelfde lading;
- Voor Thomson zijn elektronen gelijkmatig verdeeld in het atoom, maar ze hebben het vermogen om verschuiven op een versnelde manier en moeten daarom elektromagnetische straling uitzenden op bepaalde frequenties specifiek. Dit werd echter niet waargenomen.
- Het model van Thomson was vaak niet effectief in het verklaren van atomaire eigenschappen, zoals hun samenstelling en organisatie.
* Mindmap door Victor Ricardo Ferreira
Scheikundeleraar
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Thomsons atoommodel"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/o-atomo-thomson.htm. Betreden op 27 juni 2021.
Chemie

Niels Bohr, Bohr's atoom, atoomfysica, stabiel atoom, atoommodel, planetair systeem, lagen van de elektrosfeer, energieniveaus, elektronenschillen, elektronenenergie, Rutherford-atoommodel, atoom aangeslagen toestand.
Chemie

Atomen en de constructie van het heelal, atoomtheorie, dat alles is gemaakt, materie is opgebouwd uit atomen, theorie van de vier elementen, oude alchemisten, atoomtheorie, fundamenteel deeltje.