diffusie en effusie zijn twee wetten voorgesteld door de Schotse chemicus Thomas Graham, in de 19e eeuw, op basis van zijn studies over gasmengsels en het gedrag van gassen wanneer u door de wanden van een container gaat.
Onder de observaties van Thomas Graham over het gedrag van gassen in relatie tot diffusie en effusie, kunnen we het volgende benadrukken:
Een gas heeft altijd de neiging om door kleine gaatjes in vaste stof te gaan;
Hoe groter de molecuulmassa gas, hoe moeilijker het is om door de gaten van vaste stof te gaan;
Hoe lager de gasdichtheid, hoe hoger de bewegingssnelheid;
Hoe hoger de temperatuur waaraan een gas wordt blootgesteld, hoe groter de snelheid waarmee het zich in de omgeving verspreidt of door een opening gaat;
- Een gas blijft nooit statisch op een bepaalde locatie.
Diffusie
Diffusie het is een fysiek fenomeen dat bestaat in het vermogen van een gas om te diffunderen (dat wil zeggen, zich te verspreiden) door de ruimte van een gebied of in een container. Om deze reden kunnen we zeggen dat een gas in een ruimte nooit beperkt is tot één locatie.

Vertegenwoordiging van het optreden van een uitzending
Daarnaast kunnen we de diffusie nog steeds als de capaciteit die het ene gas heeft om met het andere te mengen, wanneer het in dezelfde container wordt geplaatst, waardoor een homogeen gasvormig mengsel wordt gevormd.
Een voorbeeld is wanneer er gassen uit de uitlaatgassen van voertuigen komen. Hoe giftig ze ook zijn, ze veroorzaken op korte termijn geen schade aan de mens, omdat ze zich door de atmosferische lucht verspreiden en bijgevolg hun concentratie verminderen.
Niet stoppen nu... Er is meer na de reclame ;)
effusie
effusie het is een natuurkundig fenomeen dat bestaat uit de doorgang van een gas door gaten in de wanden van een bepaalde container, dat wil zeggen, het bestaat uit het ontsnappen van een gas van de ene omgeving naar de andere.

Vertegenwoordiging van het optreden van een uitstorting
Een voorbeeld is wanneer de ballonnen worden opgeblazen voor een feestje en de volgende dag allemaal leeglopen, allemaal vanwege de lucht die ontsnapt door de gaten in de ballonnen.
Berekeningen met betrekking tot diffusie en effusie
We kunnen, volgens de door Graham voorgestelde vergelijkingen, de snelheid berekenen waarmee een gas presteert diffusie of effusie. Volgens Graham zijn de diffusie- en effusiesnelheden van twee gassen gemengd in een container: altijd omgekeerd evenredig met het kwadraat van hun relatieve dichtheden of hun molaire massa.
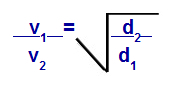
De wet van Graham met betrekking tot dichtheid
v1 = snelheid (effusie of diffusie) van gas 1 in het mengsel;
v2 = snelheid (effusie of diffusie) van het gas 2 in het mengsel;
d1 = dichtheid van gas 1 van het mengsel;
d2 = dichtheid van gas 2 van het mengsel;
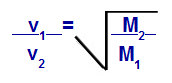
De wet van Graham met betrekking tot de molaire massa
v1 = snelheid (effusie of diffusie) van gas 1 in het mengsel;
v2 = snelheid (effusie of diffusie) van het gas 2 in het mengsel;
M1 = molmassa van gas 1 van het mengsel;
M2 = molmassa van gas 2 in het mengsel.
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Wat is diffusie en effusie?"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm. Betreden op 28 juni 2021.