Zoals weergegeven in de teksten "Elektromagnetisch spectrum van chemische elementen" en "Emissie- en absorptiespectra en de wetten van Kirchhoff”, zijn de discontinue emissiespectra van elk chemisch element anders.

Dus hieronder hebben we de verschillende spectra van enkele van deze elementen:

Zo realiseerde de Deense natuurkundige Niels Böhr (1885-1962) zich dat dit te maken kon hebben met de structuur van het atoom van elk van deze elementen. Dus stelde hij een atoommodel voor dat het model van Rutherford aanvulde, maar gericht was op het gedrag van omringende elektronen in de atoomkern.
Enige tijd eerder had Max Planck (1858-1947) een theorie voorgesteld dat elektronen gekwantiseerd, in de zin dat ze specifieke hoeveelheden energie uitstoten en absorberen, alsof het kleine pakketjes energie zijn, die hij noemde hoe veel (quantum, in het enkelvoud).
Zo stelde Böhr het volgende voor: aangezien elk element een ander spectrum heeft, heeft elk element in zijn atoom elektronen met constante en verschillende energieën van element tot element.
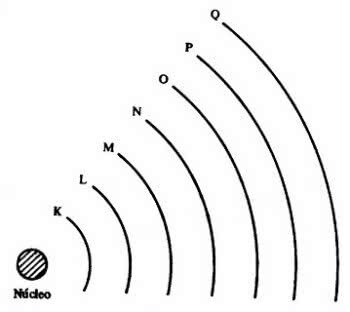
Elk elektron kan alleen in een bepaalde specifieke baan blijven, omdat het elektron in elk van deze banen een constante, goed gedefinieerde en karakteristieke energie heeft. Het elektron kan alleen de energieniveaus bezetten waarvoor het de respectieve energie heeft.
Niet stoppen nu... Er is meer na de reclame ;)
Spectra zijn discontinu omdat elektronen worden gekwantiseerd.
Een elektron kan alleen van niveau veranderen als het energie absorbeert. Wanneer u bijvoorbeeld een natriumzout verbrandt in een bunsenbrander, levert u energie aan de elektronen. Wanneer het een hoeveelheid energie absorbeert, springt het elektron naar een ander, meer energetisch niveau en blijft in de aangeslagen toestand. De grondtoestand is echter stabieler, dus dit elektron zendt de geabsorbeerde energie uit en keert terug naar zijn oorspronkelijke baan. Het zendt deze energie uit in de vorm van elektromagnetische golven die kunnen worden gevisualiseerd in de vorm van licht. In het geval van natrium is dit licht intens geel van kleur. Wanneer deze golven dus door een prisma gaan, wordt het discontinue spectrum van natrium verkregen.
Dus voor Böhr, elke lichtlijn die in het discontinue spectrum van de elementen verscheen, gaf de energie aan die vrijkwam toen het elektron terugkeerde van het ene buitenste niveau naar een dichter bij de kern.
De onderstaande afbeelding helpt om dit probleem beter te begrijpen:

Omdat de atomen van elk element alleen bepaalde energiewaarden mogen die overeenkomen met de energielagen, is er voor elk element een ander spectrum.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Elektromagnetische spectra en atoomstructuur"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm. Betreden op 27 juni 2021.