Thermisch evenwicht, ook wel thermodynamisch evenwicht genoemd, is wanneer twee lichamen of stoffen de bereiken dezelfde temperatuur.
Dit concept van thermodynamica houdt verband met de spontane warmteoverdracht (thermische energie) die optreedt tussen twee lichamen die met elkaar in contact staan.
In dit proces draagt het warmere lichaam warmte over aan het koelere lichaam totdat beide op dezelfde temperatuur zijn.

warmteoverdracht schema
De uitwisseling van energie tussen twee lichamen (warmte-energie) resulteert in het verlies van thermische energie van het warmere lichaam en de winst in energie van het koelere lichaam.
Voorbeeld
Als voorbeeld kunnen we het mengsel van warme koffie met koude melk noemen. Hoewel ze verschillende begintemperaturen hebben, draagt het heetste lichaam (koffie) in korte tijd thermische energie over aan het koudste (melk). Het mengsel wordt dus lauw als gevolg van thermisch evenwicht.
Ervan uitgaande dat koffie op 50°C was en melk op 20°C, wordt thermisch evenwicht bereikt wanneer beide op 35°C zijn.

warmte verspreiding
Het is belangrijk op te merken dat warmte de uitwisseling van energie is en de overdracht ervan op drie manieren kan plaatsvinden:
- thermische geleiding:: toename van kinetische energie;
- thermische convectie: creëren van convectiestromen;
- thermische straling:: door middel van elektromagnetische golven.
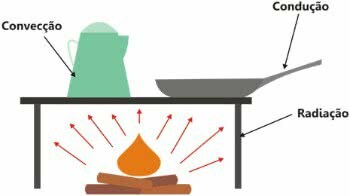
Soorten warmtevoortplanting
Lees verder: warmte verspreiding.
Formule
Om de thermische balans te berekenen, wordt de volgende formule gebruikt:
Vraag1 + Q2 + Q3... = 0 of ΣQ=0
Wezen,
Vraag: hoeveelheid warmte (lichaamstemperatuur)
We weten dus dat de som van alle thermische energieën nul is.
O voelbare warmte het is gerelateerd aan de temperatuurvariatie van lichamen. Het wordt berekend met de volgende formule:
Q = m. ç. Δθ
Waar,
Vraag: hoeveelheid voelbare warmte (limoen of J)
m: lichaamsgewicht (g of kg)
ç: soortelijke warmte van de stof (cal/g°C of J/Kg°C)
Δθ: temperatuurvariatie (°C of K)
Lees ook overCalorimetrieenWarmte en temperatuur.
Toelatingsexamen Oefeningen met feedback
1. (Mackenzie) Als we 1,0 kg water (gevoelige soortelijke warmte = 1,0 cal/g°C) bij 70°C mengen met 2,0 kg water bij 10°C, krijgen we 3,0 kg water bij:
a) 10°C
b) 20°C
c) 30°C
d) 40°C
e) 50°C
Alternatief c) 30°C
2. (UFP-RS) Overweeg de volgende uitspraken:
IK. Wanneer twee lichamen in thermisch evenwicht zijn, hebben ze allebei dezelfde hoeveelheid warmte.
II. Als twee lichamen in thermisch evenwicht zijn, hebben ze allebei dezelfde temperatuur.
III. Warmte is de overdracht van temperatuur van het ene lichaam naar het andere.
IV. Warmte is een vorm van energie die onderweg is.
Uit de bovenstaande uitspraken kan worden gezegd dat:
a) I, II, III en IV zijn correct
b) I, II, III zijn correct
c) I, II en IV zijn correct
d) II en IV zijn correct
e) II en III zijn correct
Alternatief d) II en IV zijn correct
3. (FATEC-SP) Een systeem A is in thermisch evenwicht met een andere B en dit systeem is niet in thermisch evenwicht met een andere C. We kunnen dus zeggen dat:
a) systemen A en C hebben dezelfde hoeveelheid warmte.
b) de temperatuur van A is anders dan die van B.
c) systemen A en B hebben dezelfde temperatuur.
d) de temperatuur van B is anders dan die van C, maar C kan dezelfde temperatuur hebben als in systeem A.
e) geen van bovenstaande.
Alternatief c) systemen A en B hebben dezelfde temperatuur.
4. (UFV-MG) Wanneer twee lichamen van verschillende materialen in thermisch evenwicht zijn, geïsoleerd van de omgeving, kan worden gezegd dat:
a) de heetste is degene met de minste massa.
b) ondanks het contact variëren hun temperaturen niet.
c) de heetste geeft warmte aan de koudste.
d) de koudste geeft warmte aan de heetste
e) hun temperaturen zijn afhankelijk van hun dichtheden.
Alternatief b) ondanks het contact variëren hun temperaturen niet.
5. (UFScar-SP) Twee lichamen A en B, met massa's mDE inB, zijn aanvankelijk bij temperaturen tDE en jijB, respectievelijk, met tDE tB. Op een gegeven moment worden ze in thermisch contact gebracht. Na het bereiken van thermisch evenwicht hebben we:
a) t'a > t'b
b) t'a c) t'a = t'b
d) n.v.t.
Alternatief c) t'a = t'b
Zie ook de definitie vanBalans in de natuurkunde.



