Natuurlijk radioactief vervalreeks (of familie) het is de verzameling elementen met onstabiele kernen, die een geordende opeenvolging van spontane desintegraties volgen, dat wil zeggen, ze zenden alfa- en bètadeeltjes uit, totdat een stabiele loodkern is gevormd.
Dit betekent dat alle natuurlijke radioactieve isotopen die spontaan in de natuur uiteenvallen, afkomstig zijn van drie radioactieve elementen, namelijk: thorium 232 (90232Th), uranium 238 (92238U), uranium 235 (92235u). De uranium 235 serie heet actine serie, omdat men vroeger geloofde dat het eerste element van deze familie actinium was.
Elk van deze elementen zendt een alfadeeltje uit (24α), verandert in een ander radioactief element, dat dan ook een alfadeeltje (24α) of bèta (-10β), waardoor een ander radioactief element ontstaat; enzovoort, totdat de reeks eindigt in een stabiele isotoop van het element lood (Pb).
Het eerste element van elke radioactieve reeks heet kernouder of bovenliggend element; zijnde dat de kind kernen of onderliggende elementen het zijn alle elementen die zijn ontstaan door de ouderkern.
Bekijk hieronder de volledige thorium-serie:
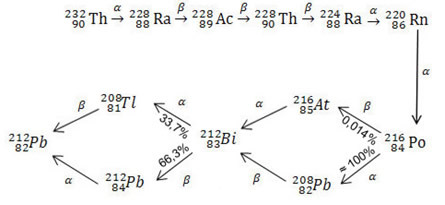
De reeksen uranium en acticnium zijn zelfs langer dan die voor thorium. De belangrijkste hiervan is uranium 235, of actinium, aangezien uranium 235 een van de belangrijkste isotopen is die als brandstof worden gebruikt in kerncentrales en bij de vervaardiging van atoomwapens.
Niet stoppen nu... Er is meer na de reclame ;)
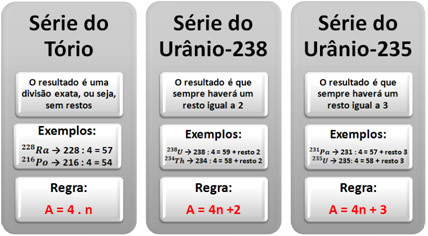
Het is mogelijk om te bepalen tot welke reeks of radioactieve familie een bepaalde radioactieve isotoop behoort als we een eenvoudige regel volgen: we delen het massagetal (A) van het element door vier; en op basis van het resultaat bepalen we de reeks van het element. Merk hieronder op hoe dit gebeurt:
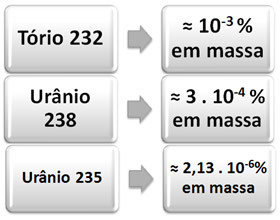
Hieronder hebben we het percentage van overvloed in de natuur van de drie genoemde elementen die aanleiding geven tot elke reeks:
De elementen van elke reeks zijn in radioactief evenwicht, wat wordt genoemd seculier evenwicht. Dit betekent dat wanneer een element uiteenvalt en een ander vormt, dit tweede element ook zijn hoeveelheid heeft. verminderd door zijn eigen desintegratie, resulterend in een die gedurende lange tijd gelijk is aan de hoeveelheid natuurlijke isotopen tijd.
Aangezien de bovenliggende elementen echter niet worden vervangen, is het te verwachten dat ze op een dag zullen opraken, evenals alle andere radioactieve elementen in de serie, waardoor alleen de stabiele voorsprong overblijft.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Radioactieve serie"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/series-radioativas.htm. Betreden op 27 juni 2021.


