In de tekst "Titel of massapercentage” we zagen hoe we de verhouding tussen de massa van de opgeloste stof en de massa van de oplossing konden berekenen, voor vaste, vloeibare en gasvormige oplossingen. In deze tekst zullen we echter zien dat het ook mogelijk is om de titer in termen van volume te berekenen, voor oplossingen met vloeibare of gasvormige componenten.

De titel in volume kan worden berekend door de uitdrukking:
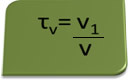
Beschouw als voorbeeld een waterige oplossing van ethylalcohol die als antiseptisch en ontsmettingsmiddel wordt gebruikt, wat bereid door 70 ml pure alcohol toe te voegen aan voldoende water om een volume van 100 ml aan te vullen oplossing. Dus we hebben:
τ = 70 ml = 0,7
100ml
We kunnen de titel ook in procenten uitdrukken, door het resultaat gewoon met 100% te vermenigvuldigen. Dus in dit geval hebben we een 70% ethylalcoholoplossing, wat betekent dat van elke 100 volume-eenheden van de oplossing, 70 volume-eenheden alcohol zijn.
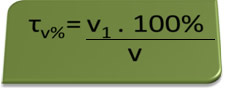
In het onderstaande geval hebben we een 70% ethylalcoholoplossing in een oplossing van 250 ml; wat betekent dat 175 ml alcohol is, volgens de berekeningen:
100 ml 70 ml alcohol
250 ml x
x = 70. 250
100
X = 175 ml alcohol

We kunnen echter niet zeggen dat we in dit geval 75 ml (250-175) water hebben. In tegenstelling tot massatiter, waarbij we de massa van het oplosmiddel kunnen toevoegen aan de massa van de opgeloste stof om de massa van de oplossing te vinden, kan dit niet worden gedaan in relatie tot de volumetiter.

Niet stoppen nu... Er is meer na de reclame ;)
Dit betekent dat het volume van de oplossing niet gelijk is aan de som van het volume van het oplosmiddel en het volume van de opgeloste stof (hoewel het verschil vaak als verwaarloosbaar kan worden beschouwd). Dit komt omdat de intermoleculaire krachten die in deze vloeistoffen bestaan, het uiteindelijke volume beïnvloeden.
In het geval van de bovengenoemde oplossing, van ethylalcohol, bijvoorbeeld, wanneer we alcohol met water mengen, is er een samentrekking van het totale volume van de oplossing; dat wil zeggen, het uiteindelijke volume zal kleiner zijn dan wanneer we alleen het volume alcohol en water zouden toevoegen. Dit komt omdat de alcoholmoleculen bindingen of waterstofbruggen tot stand brengen met de watermoleculen, waardoor de ruimte ertussen wordt verkleind.
Daarom moet in dit en andere gevallen het volume van de oplossing experimenteel worden gemeten wanneer dit niet in de oefening wordt verstrekt.
Het volumepercentage wordt veel gebruikt in gevallen van alcoholische dranken en commerciële alcohol, zoals hierboven vermeld. Zie twee belangrijke toepassingen van deze berekening:
- blaastest: de blaastest meet de concentratie van ethylalcohol in het bloed, en in Brazilië is het voor iedereen verboden om een voertuig te besturen met een alcoholgehalte in het bloed gelijk aan of hoger dan 0,1% in volume. Een persoon met dit alcoholgehalte heeft voor elke liter bloed 1 ml alcohol, zoals blijkt uit de volgende berekeningen:
τv%=V1. 100%
v
0,1 % = V1. 100%
1L
V1 = 0,1% → V1 = 0,001 L = 1 ml
100%

- Ethanolgehalte in benzine: in Brazilië wordt benzine gereguleerd door toevoeging van ethanol. Maar het ethanolgehalte in benzine mag maximaal 24 vol.% watervrije alcohol zijn (aangezien benzine watervrij moet zijn). Hoe meer ethanol aan benzine wordt toegevoegd, hoe lichter de kleur van de brandstof en de dichtheid ervan.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Volumetitel van een chemische oplossing"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm. Betreden op 28 juni 2021.
Chemie

Hoe de Breathalyzer werkt, alcoholconcentratie, breathalyzer, reacties met ethylalcohol, soorten blaastesten, kaliumdichromaat, brandstofcel, katalysator, elektronenafgifte, azijnzuur, waterstof, conce


