osmoze un šķīdinātāja pāreja, no mazāk koncentrēta šķīduma līdz koncentrētākam šķīdumam, izmantojot a puscaurlaidīga membrāna, līdz šķīduma izdarītais spiediens uz membrānu novērš šķīdinātāja pāreju. Šis process ir paredzēts līdzsvaro šķīduma koncentrāciju.
Lasīt arī: Izšķīdis un šķīdinātājs
osmotiskais spiediens
osmotiskais spiediens un spiediens uz lielāku koncentrāciju uz šķīdumu lai osmoze nenotiktu, tas ir, lai šķīdinātājs nešķērsotu daļēji caurlaidīgo membrānu.
Osmotiskais spiediens tiek izmantots ūdens atsāļošana, piespiežot procesu apgrieztā osmoze, izraisot šķīdinātāja pāreju no koncentrētāka šķīduma uz mazāk koncentrētu šķīdumu. Mēs to saucam par procesu apgrieztā osmoze. Skatiet šo attēlu, kurā salīdzināti abi procesi:
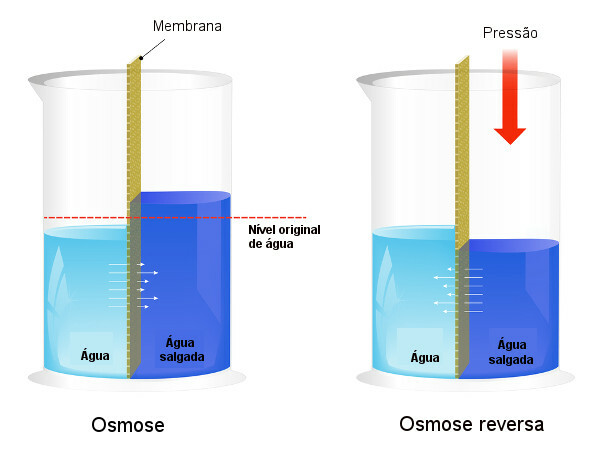
Ievērojiet, ka osmozes gadījumā šķīdinātājs iziet viskoncentrētākā šķīduma virzienā un, ka apgrieztās osmozes gadījumā caurbraukšana notiek pretējā virzienā, pateicoties pielietotajam spiedienam. Lai uzzinātu vairāk par tēmu, izlasiet mūsu tekstu: osmotiskais spiediens.
zināt vairāk: Reversā osmoze jūras ūdens atsāļošanā
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
osmotiskā spiediena vienādojums
Osmotiskais spiediens, ko apzīmē ar vēstuli pi (π) šķīduma vērtību var aprēķināt pēc šāda vienādojuma:
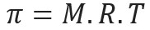
M = koncentrācija mol / l
R = ideālu gāzu universālā konstante
T = absolūtā temperatūra, K
tāpat kā citi koligatīvās īpašības, osmotiskais spiediens ir atkarīgs no šķīduma koncentrācija, tas ir, jo lielāka ir šķīduma koncentrācija, jo lielāka ir osmozes ietekme uz šķīdumiem un līdz ar to lielāks osmotiskais spiediens.
Piemēri
Osmoze mūsu ikdienas dzīvē parādās dažādos laikos. Mēs varam minēt piemēru gaļas sālīšanas process uz tavu saglabāšana. Jūs mikroorganismi tas izraisītu gaļas degradāciju zaudē ūdenino iekšpuses uz āru, kurā ir sāls koncentrācija, padarot ēdienu ilgāku.
Sāls dēļ notiek arī tas, ka salātu lapas nokalst par ūdens zaudēšanu no viņu iekšpuses šūnas (veida mazāk koncentrēts) rūdīts risinājums ārējā vidē.
Osmoze ir svarīga arī tad, kad mēs runājam asinis cilvēks. Mēs sakām, ka Sarkanās šūnas un asinis ir vienas izotoniskā vide, tas ir, viņiem ir tāds pats osmotiskais spiediens, kas ļauj viegli iekļūt ūdenī un iziet no šūnas.
Tomēr, kad asinis kļūst mazāk koncentrētas nekā sarkano asins šūnu iekšienē (hipotoniska vide), ūdens pāreja notiks vieglāk šūnas iekšpusē, padarot to uzbriest līdz pārsprāgt. Ja asinis sasniedz koncentrāciju, kas pārsniedz sarkano šūnu (hipertoniskās vides) koncentrāciju, asins šūnas nokalst, jo tie zaudē ūdeni.

Pēc tā paša gaļas saglabāšanas principa augļu saglabāšanakonfekšu kompotos, kuri saglabā ēdienu dēļ augsta cukura koncentrācija šķīdumā.
Šie ir citi piemēri, kur notiek osmoze:
- sulas pieaugumā augu vadošajos traukos;
- plkst hemodialīze;
- selektīvā barības vielu pārejā cilvēka ķermeņa šūnās.
Lai saprastu, kā osmoze notiek dzīvnieku šūnā, augu šūnā un citos bioloģiskos jautājumos, lasiet: Osmoze: kas tas ir un kā tas notiek dzīvnieku un augu šūnās.
Autors Viktors Ferreira
Ķīmijas skolotājs
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FERREIRA, Viktors Rikardo. "Osmoze"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/osmose.htm. Piekļuve 2021. gada 28. jūnijam.


