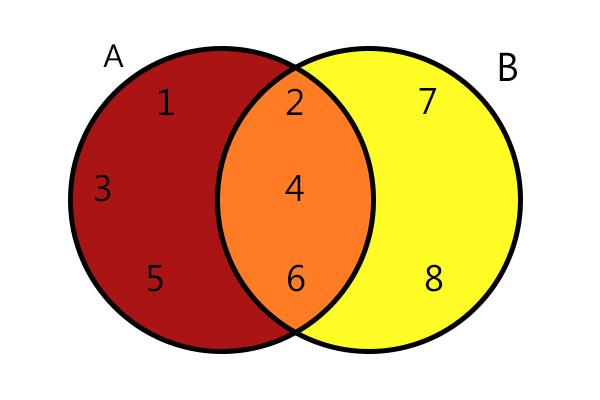
karbonskābes ir organiski savienojumi, kuriem ir karboksilfunkcionālā grupa, tas ir, ogleklis, kas veido divkāršu saiti ar skābekli un vienu saiti ar OH grupu.
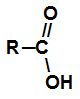
Karboksils ir katras karbonskābes funkcionālā grupa
Termiņš karbonskābe lieto, lai apzīmētu skābekli saturošu organisko funkciju, tas ir, tādu, kuras struktūrā ir skābekļa atoms. Šīs grupas savienojumiem ir kodīga spēja un skāba garša, jo tie ir skābi.
Karboksilskābju raksturojums
Vispārīgi runājot, tie šķīst organiskos šķīdinātājos;
Vienīgās ūdenī šķīstošās karbonskābes ir tās, kuru struktūrā ir līdz četriem oglekļa atomiem;
Parasti karbonskābes ir blīvākas nekā ūdens, izņemot skābes ar vienu vai diviem oglekļa atomiem;
Karboksilskābes, kurās ir līdz deviņiem ogļiem, istabas temperatūrā ir šķidras;
Cietā stāvoklī tie ir bālgani un ar vaska (vaska) izskatu;
Šķidrā stāvoklī tie ir bezkrāsaini;
Tā kā viņiem ir karboksilgrupa, viņi spēj izveidoties ūdeņraža saites;
Tās savienojumi ir polāri;
Parasti tie ir bez smaržas, izņemot skābes, kurās ir līdz trim ogļiem, kurām ir kairinoša smarža, un tās, kurās ir līdz pat sešiem ogļūdeņražiem, kurām ir pretīga smarža;
likums karbonskābju nomenklatūra
Veikt a. Nomenklatūru karbonskābe, Starptautiskā tīras un lietišķās ķīmijas savienība (IUPAC) nosaka šādu noteikumu:
Skābe
+
prefikss (atsaucoties uz ogļu skaitu ķēdē)
+
infikss (atsaucoties uz saites veidu starp oglekļa atomiem)
+
Čau līdz
Skatiet dažus piemērus:
Karboksilskābe ar sešiem oglekļa atomiem
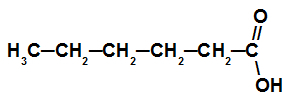
Šai skābei ir ķēde ar sešiem oglekļa atomiem (prefikss hex), tikai atsevišķas saites (infix an) un karboksilgrupa (oic), tāpēc tās nosaukums ir heksānskābe.
Karboksilskābe ar septiņiem oglekļa atomiem
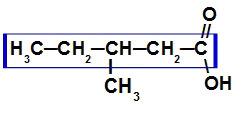
Tā kā šī skābe ir sazarota, galvenā ķēde ir tā, kurā ir vislielākais ogļu un karboksila daudzums. Šajā savienojumā galvenajai ķēdei ir pieci oglekļa atomi (prefikss pent), tikai atsevišķas saites starp oglekļa atomiem (papildinājums an) un karboksilgrupu (oic), tāpēc tā nosaukums ir skābe 3-metil-pentānskābe.
PIEZĪME: Galvenās ķēdes numerācijai vienmēr jāsākas no karboksiloglekļa.
Karboksilskābe ar diviem karboksiliem
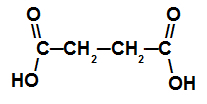
Šai skābei ir ķēde ar četriem oglekļa atomiem (prefikss bet), tikai atsevišķas saites starp oglekļa atomiem (papildinājums an) un diviem karboksilatomiem (dioīnskābe), tāpēc tā nosaukums ir skābe butāndijskābe.
PIEZĪME: Starp galotni un “dioiku” tika pievienots savienojošais patskaņs.
Ķīmiskās reakcijas ar karbonskābēm
) esterifikācijas reakcija
Tā ir ķīmiska reakcija, kurā karbonskābe reaģē ar a alkohols un veido vienu esteris un ūdens, kā parādīts šādā vienādojumā:

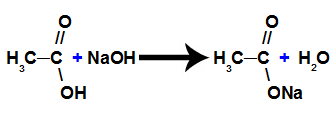
b) sāļošanās reakcija
Tā ir ķīmiska reakcija, kurā karbonskābe reaģē ar neorganisku bāzi un veido karbonskābes un ūdens sāli, kā parādīts šādā vienādojumā:
ç) eliminācijas reakcija
Šajā reakcijā divas karbonskābes molekulas tiek dehidrētas, kā rezultātā a anhidrīds un ūdens, kā parādīts šādā vienādojumā:

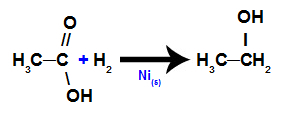
d) karbonskābju reducēšana
Šajā reakcijā karbonskābi pakļauj barotnei, kas satur gāzes ūdeņradi (H2) un cieto niķeli, kā rezultātā veidojas spirts, kā parādīts šādā vienādojumā:
Karboksilskābju pielietojums
Organisko esteru ražošana;
Karbonskābes sāļu ražošana;
Smaržu sagatavošana;
Etiķa ražošana;
Mākslīgā zīda ražošana;
dezinfekcijas līdzekļu ražošana;
Audumu krāsošana.
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-acidos-carboxilicos.htm