Jonizācija ir ķīmiska reakcija, kas izraisa jonus no ūdenī ievietotām molekulārām vielām.
Tātad, mēs varam teikt, ka jonizācija ir processjonu veidošanās.
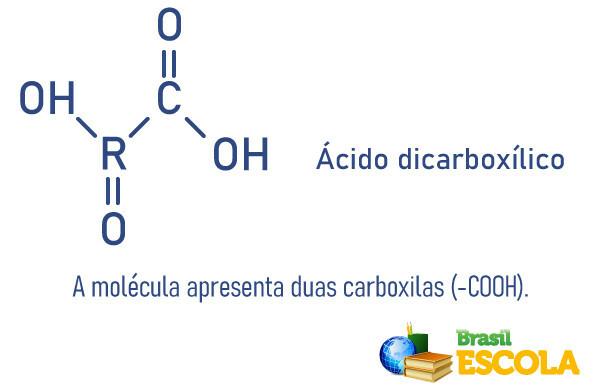
Skābes ir to vielu piemēri, kuras, ievietojot ūdenī, tiek jonizētas.
jonizācijas process
Pārskatiet, kā notiek jonizācijas process, izmantojot šo piemēru:
Ievietojot ūdenī, sālsskābe (HCl) tiek pakļauta jonizācijai. Ķīmiskā saikne starp H un Cl ir sadalīta un veidojas H joni+ un Cl-, kurus ieskauj ūdens.
Kā redzējām, H+ zaudējis elektronu un Cl- saņēma elektronu. Tomēr H+ tam ir jāstabilizējas, un tāpēc tas saistās ar ūdeni.
Tādējādi HCl jonizācijas reakciju var attēlot arī šādi:
Tagad mēs novērojam hidronija katjona (H3O+), H savienojuma rezultāts+ un no H2O.
Ir arī svarīgi atzīmēt, ka šajā piemērā Cl saņem elektronu, jo tā ir visvairāk elektronegatīvs, tas ir, tai ir tendence iegūt elektronus. Tāpēc tas viegli piesaistīja elektronus sev.
Lasiet arī:
- elektroni
- jonu, katjonu un anjonu
- Ķīmiskā reakcija
Apskatiet citus jonizācijas piemērus:
1)
2)
jonizācijas enerģija
vai jonizācijas potenciāls ir periodiska īpašība, kas norāda enerģijas daudzumu, kas vajadzīgs, lai elektronu pārnestu no atoma pamatstāvoklī.Disociācija un jonizācija
disociācija tā ir fiziska parādība, nevis ķīmiska reakcija. Tas attiecas uz esošo jonu izdalīšanos no jonu savienojumiem ūdenī.
Galvenā atšķirība starp disociāciju un jonizāciju ir:
- Jonizācija: veidojas joni;
- Disociācija: esošie joni atdalās.
Disociācijas process notiek tikai ar sāļiem un bāzēm. Piemērs: NaCl, galda sāls.
Disociācija un jonizācija ir svarīgi procesi, lai notiktu ķīmiskās reakcijas, jo brīvie joni ir vairāk reaktīvi nekā molekulas.
Lasiet arī:
- Skābes
- sāļi
- Bāzes
- jonu līdzsvars
- PH un pOH jēdziens un noteikšana
- Neitralizācijas reakcija
Noteikti pārbaudiet ieejas eksāmena jautājumus par šo tēmu ar komentētu rezolūciju: neorganisko funkciju vingrinājumi.