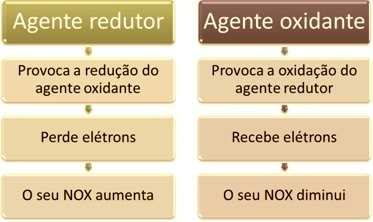
Viena no galvenajām iezīmēm, kas atšķir oksidēšanās-reducēšanās reakciju (vai redokss) no pārējiem ir oksidētāja un reducētāja klātbūtne, ko var definēt šādi:
Piemēram, zemāk aplūkojiet ķīmisko reakciju, kur alumīnijs (Al) korozē sālsskābes (HCl) ūdens šķīdumā. Alumīnija atomi elektronus pārnes uz H katjoniem+(šeit) un ražo Al katjonu3+(šeit):
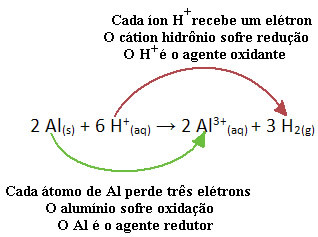
Ņemiet vērā, ka, tā kā Al pārnesa elektronus, tas nozīmē viņš izraisīja samazinājumu no H katjoniem+(šeit); tāpēc viņu sauc reducētājs. Jau katjons H+(šeit) noņemt elektronus no alumīnija, izraisot oksidēšanos no šī metāla; tāpēc viņš darbojas kā a oksidētājs.
Ikdienas dzīvē ir daudz piemēru oksidētāju un reducētāju veiktspējai. Apskatiet dažus no tiem un tomēr atcerieties, ka visos gadījumos reducēšanās notiek vienlaikus ar oksidēšanu; tādēļ, ja ir reducētājs, ir arī oksidētājs.
- Reduktoru piemēri:
- Foto filmās: fotogrāfiju filmas satur gaismas jutīgus sudraba sāļus. Vietās, kur ir gaismas sastopamība, samazinās Ag joni+, kā rezultātā rodas negatīvos novērotais kontrasts.

- C vitamīns: C vitamīns (L-askorbīnskābe) ir spēcīgs reduktors ūdens šķīdumā. Tam ir ārkārtas iespēja oksidēties, un tāpēc to plaši izmanto, jo īpaši tādos pārtikas produktos kā antioksidants, tas ir, tas tiek pievienots citiem pārtikas produktiem un aizsargā tos no iespējamās oksidēšanās, pateicoties savam upuris. Piemērs ir augļi, piemēram, āboli un bumbieri, kas saskarē ar gaisā esošo skābekli kļūst tumšāki, jo tie oksidējas. Bet, kad augļiem pievieno nelielu daudzumu apelsīnu vai citronu sulas (kas satur C vitamīnu) sagriežot, tas novērš šīs reakcijas rašanos, jo C vitamīns darbojas kā reducētājs un oksidējas pirms augļa.

- Ūdeņraža gāze: ūdeņraža gāze (H2) tiek izmantots raķešu dzinējspēkā un tiek uzskatīts par vienu no vissvarīgākajām enerģijas alternatīvām, jo tā sadedzināšana izdala lielu enerģijas daudzumu un nesatur piesārņotājus. Šajā reakcijā ūdeņradis darbojas kā reducētājs, ko oksidē skābeklis.
- Oksidētāju piemēri:
- Etiķa ražošanā: kad vīns tiek pakļauts gaisam, tas pārvēršas par etiķi, kura galvenā sastāvdaļa ir etiķskābe. Tas ir tāpēc, ka vīnā esošais etilspirts vai etanols oksidējas saskarē ar atmosfēras skābekli, kā rezultātā rodas etiķskābe. Tādējādi skābeklis ir oksidētājs. Pat termina “oksidēšanās” izcelsme ir saistīta ar reakciju ar skābekli.

- Rūsā: kā norādīts iepriekšējā piemērā, skābeklis darbojas kā alkohola oksidētājs; un tas tiek darīts arī saskarē ar dažādiem metāliem, piemēram, dzelzi, izraisot rūsēšanas procesu. Papildus skābeklim gaisā šajā gadījumā citi oksidētāji ir ūdens vai skābs šķīdums.
- Balinātājos: balinātāju iedarbība ir saistīta ar šādu divu reducētāju klātbūtni: o hipohlorīta anjons (parasti nātrija sāls formā - NaOCl), kas atrodas, piemēram, balinātājā; un ūdeņraža peroksīds (H2O2), ko tirgo kā ūdeņraža peroksīdu. Šiem diviem savienojumiem ir ļoti spēcīga tieksme oksidēties un izraisīt citu ķīmisko sugu samazināšanos. Tāpēc viņi ir atbildīgi par vielu oksidēšanu, kas produktiem piešķir tumšu krāsu. Piemēram, celulozē lignīns tiek sadalīts un kļūst vieglāks un kaļamāks. Traipu noņemšanas un auduma balināšanas gadījumā šie oksidētāji izraisa organisko molekulu, piemēram, tauku un krāsvielu, oksidēšanu.

- Alkometros: vienkāršs vienreiz lietojams alkometrs sastāv no caurspīdīgas caurules, kas satur sērskābē samitrinātu kālija un silīcija dioksīda dihromāta sāls ūdens šķīdumu; sajauc ar oranžu krāsu. Šis sāls, nonākot saskarē ar alkohola tvaikiem, kas atrodas dzērājšofera izelpā, reaģē, mainot krāsu uz zaļu. Tas nozīmē, ka tiek izraisīta etanola (spirta) oksidēšanās etanālā.

Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm


