Mācīties pielietot pirmo termodinamikas likumu dažādās situācijās, risināt uzdevumus un pārbaudīt savas zināšanas ar atrisinātiem un izskaidrotiem uzdevumiem.
jautājums 1
Pirmais termodinamikas likums nosaka, ka:
a) Enerģiju nevar radīt vai iznīcināt, bet to var pārvērst no vienas formas citā.
b) Enerģija vienmēr tiek saglabāta, bet to nevar pārvērst no vienas formas citā.
c) Enerģiju var radīt vai iznīcināt, bet to nevar pārvērst no vienas formas citā.
d) Enerģiju nevar saglabāt, bet to var pārvērst no vienas formas citā.
Pirmais termodinamikas likums ir enerģijas saglabāšanas princips, tātad sistēmā slēgts, enerģijas daudzums paliek nemainīgs un to var pārveidot tikai no vienas formas citā. cits.
2. jautājums
Pieņemsim slēgtu sistēmu, kas saņem 100 J siltuma, vienlaikus veicot 50 J darbu. Kādas ir sistēmas iekšējās enerģijas izmaiņas?
a) -50 J
b) 0 J
c) 50 J
d) 100 J
e) 150 J
Zīmju pārbaude:
Saņemtais siltums ir pozitīvs Q > 0.
Paveiktais darbs ir pozitīvs W = 0.
Saskaņā ar pirmo likumu mums ir:
3. jautājums
Ideāla gāzes sistēma apmainās ar 500 džouliem siltuma ar ārējo vidi. Pieņemot, ka šis process ir izometriska dzesēšana, nosaka attiecīgi darbu un iekšējo enerģiju.
a) 500 J un 0 J
b) - 500 un 0 J
c) 0 J un 500 J
d) 0 J un - 500 J
e) -500 J un 500 J
Tā kā process ir izometrisks, apjoms nemainās, tāpēc darbs ir nulle.
Saskaņā ar pirmo termodinamikas likumu:
Tā kā tā ir dzesēšana, sistēma zaudē siltumu, tāpēc:
4. jautājums
8 moli ideālas gāzes virzuļcilindru sistēmā tiek saspiesti, veicot 1000 J darbu. Procesa laikā ārējai videi tiek zaudēti 400 J siltuma. Tās iekšējā enerģija un temperatūras izmaiņas ir attiecīgi vienādas ar
Dots: R = 8,31 J/mol. K
a) - 1400 J un aptuvenā variācija 6 K
b) 600 J un aptuvenā variācija 6 K
c) 600 J un aptuvenā variācija 14 K
d) — 1400 J un aptuvenā variācija 14 K
iekšējā enerģija
Sistēma saņemot darbu, tās zīme ir negatīva, kā arī siltums, kas šajā procesā tiek zaudēts.
Pirmais termodinamikas likums ir:
Aizstājot vērtības, mēs iegūstam:
R = 8,31 J/mol K
Temperatūra
Saskaņā ar Džoula likumu mums ir:
5. jautājums
Ideāla gāze tiek saspiesta, veicot 500 J darbu. Šīs transformācijas beigās sistēmas iekšējā enerģija mainījās par 200 J mazāk nekā sākumā. Gāzes apmainītais siltuma daudzums bija
a) — 700 J
b) — 300 J
c) 300 J
d) 0 J
e) 700 J
Kopš saņemts darbs, tas ir, izturīgs darbs, tā zīme ir negatīva.
Vērtību aizstāšana termodinamikas pirmā likuma vienādojumā:
6. jautājums
(CEDERJ 2021) Cikla posmā, ko gaisa kondicionētājā veic ar ideālu gāzi, gāzes spiediens tiek palielināts, saglabājot nemainīgu tilpumu. Šajā cikla posmā gāzes veiktais darbs W, tās absorbētais siltuma daudzums Q un temperatūras izmaiņas ΔT ir attiecīgi:
a) W < 0, Q < 0 un ΔT < 0
b) W = 0, Q > 0 un ΔT > 0
c) W = 0, Q = 0 un ΔT = 0
d) W > 0, Q > 0 un ΔT > 0
Dati:
Spiediens P palielinās;
Skaļums paliek nemainīgs;
Darbs
Tā kā tilpums ir nemainīgs, darbs W ir vienāds ar nulli.
Pirmais termodinamikas likums ir šāds:
Tā kā siltums ir pozitīvs, arī iekšējās enerģijas izmaiņas būs pozitīvas.
Siltums
Tā kā siltums tiek absorbēts, tas ir pozitīvs.
Temperatūra
Saskaņā ar gāzes likumu:
kur,
n ir molu skaits
R ir universālā gāzes konstante
Tādējādi temperatūra ir atkarīga tikai no spiediena, jo tilpums ir nemainīgs, pozitīvs.
7. jautājums
(UNICENTRO 2018) Saskaņā ar Pirmo termodinamikas likumu sistēmas iekšējās enerģijas izmaiņas ΔU ir ko nosaka starpība starp siltuma apmaiņu ar ārējo vidi Q un procesā paveikto darbu W termodinamiskā. Ņemot vērā šo informāciju, ja monatomiskā gāze izplešas tā, lai vienmēr paliktu tajā pašā temperatūrā, šo transformāciju var attēlot ar vienādojumu
a) ΔU + W = 0
b) ΔU − W =0
c) Q – W = 0
d) Q + ΔU = 0
Izotermisks process notiek bez temperatūras izmaiņām.
Enerģija ir saistīta ar temperatūru:
Kur n ir molu skaits un R ir universālā gāzes konstante. Tā kā n un R ir nemainīgi, pastāv tikai temperatūras svārstības, un
Pirmais termodinamikas likums ir šāds:
8. jautājums
(URCA 2016) Saskaņā ar pirmo termodinamikas likumu, ja izotermiska procesa laikā, ko veic ideāla gāze ar fiksētu masu, gāze izdalās siltuma daudzums, kura lielums ir 50 cal, tad iekšējās enerģijas izmaiņas un gāzes veiktais darbs šajā procesā ir, attiecīgi:
a) 0 un 50 cal.
b) 50 cal un 0.
c) 0 un 0.
d) 50 cal un -50 cal.
e) 0 un -50 cal.
Iekšējās enerģijas izmaiņas ir tieši saistītas ar temperatūras izmaiņām. Tā kā process ir izotermisks, temperatūras izmaiņas nav, tāpēc .
No pirmā termodinamikas likuma:
Tā kā siltums izdalās, tā zīme ir negatīva.
9. jautājums
(UFRN 2012) Biomasa ir viens no galvenajiem atjaunojamās enerģijas avotiem, un tāpēc iekārtas, kas to izmanto kā degvielu elektroenerģijas ražošanai, ir svarīgas no vides viedokļa. Ļoti izplatīts piemērs ir biomasas izmantošana, lai darbinātu tvaika turbīnu, lai radītu darbu. Sānu attēlā shematiski parādīta vienkāršota termoelektriskā elektrostacija.
Šajā termoelektriskajā iekārtā biomasas sadedzināšana krāsnī rada siltumu, kas silda ūdeni katlā un rada augstspiediena tvaiku. Savukārt tvaiks pa caurulēm tiek novadīts līdz turbīnai, kura savas darbības rezultātā sāk griezt lāpstiņas.
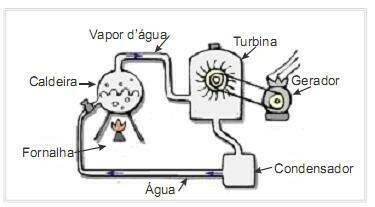
Pieņemt, ka siltuma zudumi temperatūras atšķirību dēļ starp šī siltumdzinēja daļām un vidi ir nenozīmīgi. Šajā kontekstā katla ūdens iekšējās enerģijas izmaiņas
a) ir lielāka par siltuma summu, kas tai tiek piegādāta, sadedzinot biomasu un darbu, kas veikts pie turbīnas.
b) ir vienāds ar siltuma summu, kas tai tiek piegādāta, sadedzinot biomasu ar turbīnas darbu.
c) ir vienāda ar starpību starp siltumu, kas tam tiek piegādāts, sadedzinot biomasu, un darbu, kas veikts pie turbīnas.
d) ir lielāka par starpību starp siltumu, kas tam tiek piegādāts, sadedzinot biomasu, un turbīnā veikto darbu.
Ūdens katlā saņem enerģiju siltuma veidā no kurināmā sadedzināšanas un izdala enerģiju turbīnā veiktā darba veidā.
10. jautājums
(UECE 2021) Attiecībā uz gāzu īpašībām pievērsiet uzmanību šādiem apgalvojumiem:
i. Ideālai gāzei iekšējā enerģija ir tikai spiediena funkcija.
II. Siltums, ko gāze absorbē, mainot stāvokli, nav atkarīgs no procesa.
III. Ideālas gāzes iekšējā enerģija ir tikai temperatūras funkcija un nav atkarīga no procesa.
IV. Ideālas gāzes izotermiskā izplešanās gadījumā tās veiktais darbs ir vienāds ar absorbēto siltumu.
Pareizi ir tas, kas teikts tikai
a) I un II.
b) III un IV.
c) I un IV.
d) II un III.
III. PAREIZI. Ideālas gāzes iekšējā enerģija ir tikai temperatūras funkcija un nav atkarīga no procesa.
Iekšējās enerģijas izmaiņas ir tieši saistītas ar temperatūras izmaiņām.
Kur n ir molu skaits un R ir ideālā gāzes konstante, jo tā ir konstante, tikai temperatūra nosaka gāzes iekšējo enerģiju.
IV. PAREIZI. Ideālas gāzes izotermiskā izplešanās gadījumā tās veiktais darbs ir vienāds ar absorbēto siltumu.
Tā kā tas ir izotermisks, temperatūra nemainās, tāpēc iekšējās enerģijas izmaiņas ir nulle. Saskaņā ar pirmo termodinamikas likumu:
Uzziniet vairāk, izmantojot:
- Pirmais termodinamikas likums
- Termodinamika: likumi, jēdzieni, formulas un vingrinājumi
- Termodinamikas vingrinājumi
- gāzes likums
ASTH, Rafaels. Pirmā termodinamikas likuma vingrinājumi.Visa Matter, [n.d.]. Pieejams: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Piekļuve:
Skaties arī
- Termodinamikas vingrinājumi
- Termodinamika
- adiabātiskā transformācija
- Termoķīmijas vingrinājumi
- Pirmais termodinamikas likums
- Dabaszinātnes un to tehnoloģijas: Enem
- Siltumenerģija
- Otrais termodinamikas likums
