THE oganesson, simbols Og, atomskaitlis 118, ir ķīmiskais elements ar līdz šim augstāko atomskaitli periodiskajā tabulā. Dabā to nevar atrast, un tā ražošana ir mākslīga, tāpēc to uzskata par sintētisku elementu. Tomēr tā izgatavošana ir ļoti sarežģīta, un to uzskata par ļoti retu elementu, jo tas ir sintezēts ļoti maz.
Neskatoties uz to, ka esat vienā grupā ar cēlgāzes, oganessonam nav daudz īpašību, kas attiecas uz šiem elementiem, saskaņā ar aprēķiniem matemātiķi relativistiskās ietekmes rezultātā pierāda, ka cieš supersmagie elementi.
Elements 118 pirmo reizi tika sintezēts 2002. gadā, jonu reakcijas rezultātā 48Ca ar atomiem 249Skat Tās nosaukums ir veltījums krievu zinātniekam Jurijam Oganessianam, vienam no cienījamākajiem un atzītākajiem supersmago elementu jomā.
Skatīt arī: Rutherfordium — sintētiskais ķīmiskais elements, kas nosaukts zinātnieka Ernesta Raterforda vārdā
Kopsavilkums par oganesson
Oganesons ir sintētisks ķīmiskais elements, kas atrodas 18. grupā Periodiskā tabula.
Pirmo reizi tas tika sintezēts 2002. gadā, Krievijas un Amerikas zinātnieku kopdarbā.
Tas veido elementu grupu, kas pēdējo reizi tika iekļauta periodiskajā tabulā 2016. gadā.
Tas ir ļoti rets elements, kas sintezēts ļoti reti.
Viņu pētījumi joprojām ir ļoti neseni, un pamata īpašības joprojām nosaka aprēķini un matemātiskie modeļi.
Sākotnējie teorētiskie testi liecina, ka, neskatoties uz piederību cēlgāzu grupai, dažas īpašības attālina Og no citiem elementiem.
Oganesona ražošana notiek līdz Kodolsintēze, izmantojot jonus no 48Ca un atomi 249Skat
Tās nosaukums ir veltījums krievu zinātniekam Jurijam Oganessianam, vienam no nozīmīgākajiem supersmago elementu izpētes jomā.
Oganessona īpašības
Simbols: ak
Atomu skaits: 118.
Atomu masa: 294 c.u. (neoficiāls Iupac).
Elektroniskā konfigurācija: [Rn] 7s2 5f14 6.d10 7p6.
Stabilākais izotops: 294Og (0,69 milisekundes pussabrukšanas periods, ko var palielināt par 0,64 milisekundēm vai samazināt par 0,22 milisekundēm).
Ķīmiskā sērija: 18. grupa, supersmagie elementi, cēlgāzes.
Oganessona raksturojums
Oganesson ir līdz šim oficiāli apstiprinātais augstākais atomu skaita elements (118). Starptautiskā tīrās un lietišķās ķīmijas savienība (IUPAC). Lai gan tas pirmo reizi tika ražots 2002. par viņu ir maz zināms. Joprojām daudz tiek spekulēts, jo šis elements dabā nav atrodams. Tā ražošana tiek veikta laboratorijā, kas to konfigurē kā sintētisku elementu.
Turklāt jūsu Pus dzīve ir mazāks par milisekundi (10-3 otrais) — atceroties, ka pussabrukšanas periods ir laiks, kas nepieciešams, lai daudzums samazinātos uz pusi. Tāpēc īpašības, kas tiek noteiktas šim elementam, nav nekas cits kā rezultāti teorētiskos aprēķinus, pamatojoties uz matemātiskiem modeļiem, jo periodiskās tabulas reģionā, kurā tas ir atrod relatīvistiskie efekti (neatbilstība starp sagaidāmo un novēroto ietekmi relativitātes teorijas rezultātā) ir nozīmīga.
Relativistiskie efekti atņem Ogu no tā, kas no viņa tika gaidīts. Elements, piemēram, nav līdzīgas cēlgāzēm. Aprēķini liecina, ka oganesons istabas temperatūrā būtu cieta viela ar kušanas temperatūru diapazonā no 325 ± 15 K (apmēram 52 °C) un viršanas temperatūru diapazonā no 450 ± 10 K (apmēram 177 °C).
Ir arī zināms, ka Og var būt reaktīvāks nekā citas cēlgāzes, jo relativistiskie efekti ļauj tam vieglāk zaudēt p-apakšlīmeņa elektronus. Vēl viens domstarpību punkts ar cēlgāzēm ir tas, ka oganessons ir a pusvadītājs, bet pārējie ir izolatori.
Izlasi arī: Ūdeņradis — ķīmiskais elements, kuram ir mazākais atomskaitlis periodiskajā tabulā
Oganessona iegūšana
Tāpat kā citi īpaši smagie elementi, oganesson tiek iegūts, izmantojot tehniku, ko sauc par karsts kausējums, kur izotopu joni 48Ca, kas atrodams dabā, bet ļoti maz pieejams, reaģē ar daudz smagākiem izotopiem, veidojot supersmagos elementus.
Og ir tik rets un grūti iegūstams elements, ka Desmit gadu laikā tikai četri atomi nāca ražot. Būtībā, ražošana 294Og, vienīgais zināmais izotops, rodas, bombardējot jonus 48Ca līdz kodolam 249Skat., ar 3 neitronu izdalīšanos.
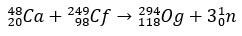
Ar dažu milisekundžu pussabrukšanas periodu Og tika identificēts, izmantojot tā sabrukšanas modeli, kaut kas ļoti izplatīts īpaši smagiem elementiem. Šajā gadījumā notika 3 alfa sabrukšana, kā rezultātā elements 118 kļuva par koperniciju Cn, kas, visbeidzot, spontāni dalījās.
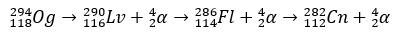
oganessona vēsture
Pirmā oganessona sintēze notika 2002. gadā., Livermoras pilsētā, Kalifornijā, Amerikas Savienotajās Valstīs, Lorensa Livermoras Nacionālajā laboratorijā, kur amerikāņu zinātnieku grupa sadarbojās ar krievu pētniekiem slavenais Apvienotais kodolpētījumu institūts (JINR), kuru vadīja krievu zinātnieks Jurijs Oganessans.
Desmit gadu laikā kopš pirmās sintēzes reakcijas parametru retuma un sarežģītības dēļ tika sintezēti tikai četri oganesona atomi. Tomēr ceturtais un pēdējais atoms sniedza neticamu atklājumu.
Zinātnieki mēģināja sintezēt elementu 117, reaģējot uz 48Ca ar 249Bk, tomēr tika novērots, ka 28% no berķelija mērķa tika veikta β sabrukšana, pārvēršoties par 249Skatīt un tādējādi ģenerēt elementu 118. Jāatzīmē, ka elementa 118 nosaukums godina krievu zinātnieku Juriju Oganessianu, cieņa, kas dzīvajiem ķīmiķiem ir bijusi tikai divas reizes ķīmijas vēsturē, pirmā ir Glenam Sīborgam ar Seaborgium.
Atrisināja vingrinājumus par oganessonu
jautājums 1
Oganesone, elements ar atomskaitli 118 un simbolu Og, tika ievietots Periodiskās tabulas septītajā periodā, cēlgāzu grupā. Rezultātā ir daudz spekulēts par to, vai šāds elements varētu nodrošināt lielu stabilitāti, kas ir raksturīga citiem šīs grupas elementiem. Og iedalīšana 18. grupā bija saistīta ar:
A) šis elements ir ļoti stabils.
B) šī elementa valences apvalkā ir astoņi elektroni.
C) šis elements ir acīmredzami gāze istabas temperatūrā.
D) šim elementam ir tādas pašas ķīmiskās īpašības kā citām cēlgāzēm.
E) šim elementam ir augsta jonizācijas enerģija.
Izšķirtspēja:
Alternatīva B
Og piešķiršana notiek tikai un vienīgi tā dēļ elektroniskā izplatīšana. Fakts, ka tajā ir astoņi elektroni valences slānis, 7s2 7p6, novieto to šajā pozīcijā. Pētījumi ar šo elementu vēl ir provizoriski, taču matemātisko rezultātu dēļ jau tiek uzskatīts, ka, piemēram, Og nav gāze istabas temperatūrā. Vēl viens aspekts, kas jāuzsver, ir tas, ka Og nemaz nav stabils, pat neeksistē dabā.
2. jautājums
Lielās grūtības radīt elementu 118 rada domu, ka zinātnieki atradās īstā odisejā, lai varētu to atklāt. Nav brīnums, ka pēc desmit gadus ilgas pirmās sintēzes oganesson tika sintezēts tikai trīs citas reizes. Un līdz šim ir zināms tikai viens izotops, 294ak Cik neitronu ir zināmajam oganessona izotopam?
A) 294.
B) 118.
C) 176.
D) 412.
E) 166.
Izšķirtspēja:
Alternatīva C
Skaits neitroni Og var aprēķināt šādi:
A = Z + n
A ir skaitlis makaroni atomu, Z ir protonu skaits (vai atomskaitlis), un n ir neitronu skaits. Aizstājot vērtības, mums ir:
294 = 118 + n
n = 294–118
n = 176
Autors Stefano Araújo Novais
Ķīmijas skolotājs
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/oganessonio-og.htm
