Eksperimenti ir praktisks veids, kā mācīties un pārbaudīt savas zināšanas par ķīmijā studētajiem jēdzieniem.
Izmantojiet šos ķīmiskos eksperimentus, kurus var veikt mājās (pieaugušo uzraudzībā) vai strādāt kopā ar skolotāju klasē, lai papildinātu savas studijas.
1. pieredze - krāsu atšķetināšana
Iesaistītās koncepcijas: hromatogrāfija un maisījumu atdalīšana
Materiāli
- daudzkrāsainas pildspalvas
- alkohols
- kafijas filtrpapīrs
- kauss (stikls, lai atvieglotu eksperimenta uzraudzību)
Kā pagatavot
- Izmantojiet šķēres un sagrieztas filtrpapīra sloksnes. Par katru izmantoto pildspalvu izveidojiet taisnstūri.
- Tagad, aptuveni 2 cm attālumā no pamatnes, ar izvēlētās krāsas pildspalvu uzzīmējiet apli un nokrāsojiet visu iekšpusi.
- Līmējiet papīra malu vistālāk no uzzīmētā marmora uz atbalsta. Šim nolūkam varat izmantot lenti un piestiprināt to pie zīmuļa.
- Pievienojiet alkoholam glāzi, ne pārāk daudz, jo tai vienkārši jāpieskaras papīra galam pie pildspalvas zīmes.
- Ievietojiet papīru kausā tā, lai tas būtu vertikāls. Zīmulim, kas to atbalsta, jābalstās uz malām.
- Pagaidiet no 10 līdz 15 minūtēm, līdz spirts palielinās caur filtrpapīru. Pēc tam noņemiet papīrus un ļaujiet tiem nožūt.
Rezultāts
Kad spirts iziet cauri pildspalvas zīmei, tas mijiedarbojas ar krāsu komponentiem un dzen tos pa papīru. Tādējādi dažādi pigmenti tiks atdalīti saskarē ar spirtu.
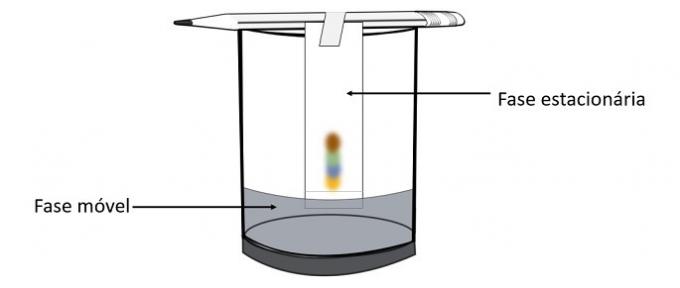
Veicot šo eksperimentu, ir iespējams uzzināt, kuras krāsas tika sajauktas, lai izveidotu pildspalvas krāsu.
Paskaidrojums
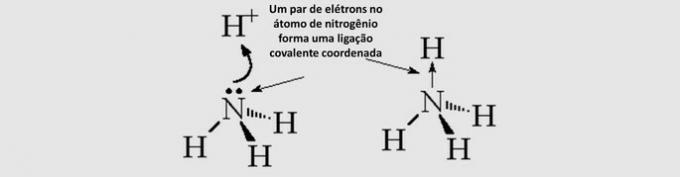
Hromatogrāfija ir maisījumu atdalīšanas veids. Filtrpapīrs ir stacionārā fāze, un alkohols ir kustīgā fāze, kas velk maisījuma komponentus, kad tā šķērso stacionāro fāzi. Šajā procesā, jo lielāka ir mijiedarbība ar spirtu, jo ātrāk pigments pārvietosies ar šķīdinātāja pāreju.
Materiāla sastāvdaļas, jo tām ir dažādas īpašības, mijiedarbosies ar kustīgo fāzi dažādos veidos, ko var pamanīt dažādie vilkšanas laiki stacionārajā fāzē.
Uzziniet vairāk par hromatogrāfija.
2. pieredze - pārtikas saglabāšana
Iesaistītie jēdzieni: organiskie savienojumi un ķīmiskās reakcijas
Materiāli
- ābols, banāns vai bumbieris
- citrona vai apelsīnu sula
- C vitamīna tablete
Kā pagatavot
- Izvēlieties vienu no trim augļiem un sagrieziet to 3 vienādās daļās.
- Pirmais skaņdarbs kalpos kā salīdzinājums ar citiem. Tāpēc neko tam nepievienojiet, vienkārši atstājiet to gaisā.
- Vienā no gabaliņiem piliniet citrona vai apelsīna saturu. Izklājiet tā, lai visa augļa iekšpuse būtu pārklāta ar sulu.
- Pēdējā daļā izklājiet C vitamīnu, tā var būt sasmalcināta tablete visā augļu mīkstumā.
- Skatieties, kas notiek, un salīdziniet rezultātus.
Rezultāts
Augļa mīkstumam, kas ir bijis pakļauts gaisam, vajadzētu ātri satumst. Citronu vai apelsīnu sulai un C vitamīnam, ķīmiskai vielai, ko sauc par askorbīnskābi, vajadzētu palēnināt augļa brūnināšanu.

Paskaidrojums
Kad mēs sagriež augli, tā šūnas tiek bojātas, atbrīvojot fermentus, piemēram, polifenola oksidāzi, kas iekšā saskarē ar gaisu oksidē pārtikā esošos fenola savienojumus un izraisa fermentatīvo brūnumu.
Lai novērstu skābekļa darbību, tiek izmantoti konservanti, piemēram, askorbīnskābe, jo tie galvenokārt tiek oksidēti fenola savienojumu vietā. Papildus C vitamīna tabletei askorbīnskābe ir arī dabiskos avotos, piemēram, citrusaugļos, citronā un apelsīnā, kas ieteikts eksperimentā.
Uzziniet vairāk par oksidēšanās.
3. pieredze - kurš ātrāk sasalst?
Iesaistītie jēdzieni: koligatīvās īpašības un krioskopija
Materiāli
- divas caurules (izmanto ballīšu labā)
- stikla trauks
- galda sāls
- filtrēts ūdens
- ledus
- termometrs
Kā pagatavot
- Abām mēģenēm pievieno tādu pašu daudzumu filtrēta ūdens. Piemēram, 5 ml katrā mēģenē.
- Pievienojiet galda sāli vienai no mēģenēm un ievietojiet identifikācijas lenti, lai atšķirtu, kura ir sāļa.
- Stikla trauku piepilda ar sasmalcinātu ledu un pievieno nedaudz sāls.
- Novietojiet abas caurules vienlaicīgi ledus iekšpusē un vērojiet, kas notiek.
- Katrai situācijai pierakstiet sasalšanas temperatūru.
Rezultāts
Izšķīdušās vielas pievienošana ūdenim pazemina sasalšanas temperatūru. Tāpēc tīram ūdenim ir tendence sasalt daudz ātrāk nekā sāls un ūdens šķīdumam, ja tiek pakļauti vienādiem apstākļiem.
Paskaidrojums
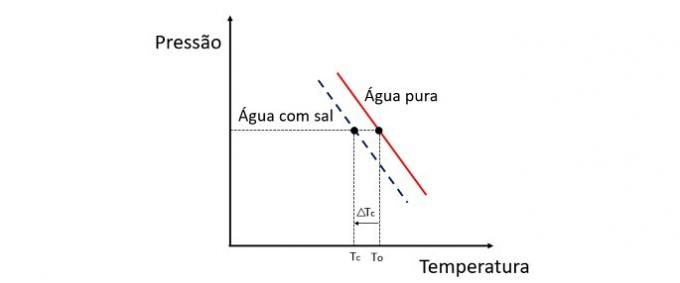
Krioskopija ir koligatīvs īpašums, kas pēta šķīdinātāja temperatūras izmaiņas, kad tajā izšķīdina dažādus izšķīdušās vielas daudzumus.
Ūdens sasalšanas temperatūras pazemināšanos izraisa negaistoša izšķīdušā viela, un šai parādībai ir daudz praktisku pielietojumu. Tāpēc lielāka izšķīdušās vielas koncentrācija šķīdumā ietekmē krioskopisko efektu.
Ja, piemēram, ūdens sasalst 0 ° C temperatūrā un mēs tam pievienojam sāli, fāzes maiņas temperatūra būs negatīva, ti, daudz zemāka.
Tāpēc jūras ūdens nesasalst vietās, kuru temperatūra ir zemāka par 0 ° C. Ūdenī izšķīdināta sāls mēdz vēl vairāk pazemināt sasalšanas temperatūru. Vietās, kur ir sniegs, ir arī ierasts mest sāli uz ceļiem, lai izkausētu ledu un izvairītos no negadījumiem.
Uzziniet vairāk par koligatīvās īpašības.
4. eksperiments - ūdeņraža peroksīda sadalīšanās
iesaistītie jēdzieni: ķīmiskā reakcija un katalizators
Materiāli
- Puse neapstrādāta kartupeļu un puse vārīta
- Neapstrādātu aknu gabals un vēl viens vārīts gabals
- Ūdeņraža peroksīds
- 2 ēdieni
Kā pagatavot
- Katrā ēdienā pievienojiet pārtiku, kopā kartupeļus un aknas kopā.
- Katrā no četriem materiāliem pievieno 3 pilienus ūdeņraža peroksīda.
- Skatieties, kas notiek, un salīdziniet rezultātus.
Rezultāts
Ūdeņraža peroksīds, ūdeņraža peroksīda šķīdums, nonākot saskarē ar neapstrādātu pārtiku, gandrīz uzreiz sāk putot.
Šo eksperimentu var veikt arī, pievienojot pārtikas gabalu traukā ar ūdeņraža peroksīdu, lai reakcija būtu pamanāmāka.
Paskaidrojums
Putekļainība, ko rada ūdeņraža peroksīds, nonākot saskarē ar neapstrādātu pārtiku, raksturo ķīmiskās reakcijas rašanās, kas ir ūdeņraža peroksīda sadalīšanās un gāzes izdalīšanās skābeklis.
Ūdeņraža peroksīda sadalīšanās notiek, darbojoties katalāzes enzīmam, kas atrodas dzīvnieku un augu šūnās esošajā peroksisomu organellā.
Ir svarīgi uzsvērt, ka ūdeņraža peroksīda sadalīšanās notiek spontāni, saules gaismas klātbūtnē, bet ļoti lēni. Tomēr katalāze darbojas kā katalizators, palielinot ķīmiskās reakcijas ātrumu.
Ūdeņraža peroksīds var būt toksiska viela šūnām. Tāpēc katalāze noārda savienojumu un ražo ūdeni un skābekli - divas vielas, kas nekaitē ķermenim.
Gatavojot ēdienu, tiek mainītas tā sastāvdaļas. Vārīšanas izraisītās modifikācijas arī denaturējot olbaltumvielu, apdraud katalāzes darbību.
Tāda pati darbība, kādu mēs redzam ar pārtiku, notiek arī tad, ja uz brūces uzliekam ūdeņraža peroksīdu. Katalāze darbojas un rodas burbuļi, kas sastāv no skābekļa izdalīšanās.
Uzziniet vairāk par ķīmiskās reakcijas.
Bibliogrāfiskās atsauces
SAINTS, W. L. P.; MOL, G. S. (Koords.). Pilsoņu ķīmija. 1. ed. Sanpaulu: jaunā paaudze, 2011. gads. v. 1, 2, 3.
BRAZĪLIJAS ĶĪMISKĀ SABIEDRĪBA (org.) 2010. Ķīmija jūsu tuvumā: K-12 klases zemu izmaksu eksperimenti. 1. ed. Sanpaulu.