Niobijs (Nb) ir atoma skaitļa 41 ķīmiskais elements, kas pieder periodiskās tabulas 5. grupai.
Tas ir dabiski pieejams pārejas metāls cietā stāvoklī, kuru 1801. gadā atklāja britu ķīmiķis Čārlzs Hačets.
Minerāli, kas satur niobiju, pasaulē ir reti sastopami, taču to ir daudz Brazīlijā, valstī ar lielākajām šī metāla rezervēm.
Pateicoties tā īpašībām, augstajai vadītspējai un izturībai pret koroziju, šim elementam ir daudz pielietojumu, sākot no tērauda ražošanas līdz raķešu ražošanai.
Tālāk mēs iepazīstināsim ar šo ķīmisko elementu un īpašībām, kas to padara tik svarīgu.
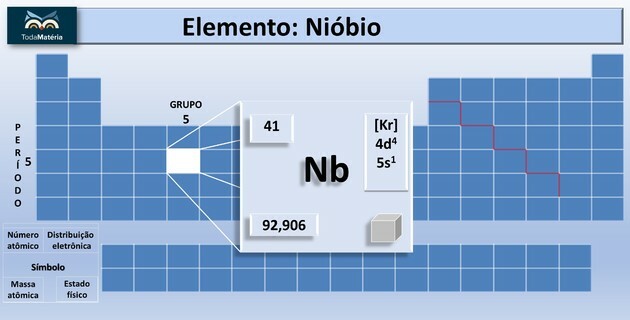
Kas ir niobijs?
Niobijs ir ugunsizturīgs metāls, tas ir, tas ir ļoti izturīgs pret karstumu un nodilumu.
Šīs klases metāli ir: niobijs, volframs, molibdēns, tantals un renijs, no kuriem niobijs ir visvieglākais.
Niobijs dabā sastopams minerālos, parasti saistīts ar citiem elementiem, galvenokārt ar tantalu, jo abiem tiem ir ļoti līdzīgas fizikāli ķīmiskās īpašības.
Šis ķīmiskais elements periodiskajā tabulā tiek klasificēts kā pārejas metāls. Tas ir spilgts, ar zemu cietību, ar nelielu pretestību elektriskās strāvas pārejai un izturīgs pret koroziju.
Niobija fizikālās īpašības
| fiziskais stāvoklis | cieta istabas temperatūrā |
|---|---|
| krāsa un izskats | metāliski pelēks |
| Blīvums | 8,570 g / cm3 |
| Kodolsintēzes punkts | 2468 ° C |
| Vārīšanās punkts | 4742 ° C |
| Kristāliskā struktūra | Ķermeņa centrētais kubiskais - CCC |
siltumvadītspēja |
54,2 W m-1 K-1 |
Niobija ķīmiskās īpašības
| Klasifikācija | pārejas metāls |
|---|---|
| atomu skaitlis | 41 |
| Bloķēt | d |
| Grupa | 5 |
| Laika kurss | 5 |
| atomu svars | 92,90638 u |
| atomu stars | 1,429 Å |
| parastie joni | Nb5+ un Nb3+ |
| elektronegativitāte | 1.6 Paulinga |
Galvenā šī metāla izmantošanas priekšrocība ir tā, ka var tikai šī elementa daudzums gramos modificēt tonnu dzelzs, padarot metālu vieglāku, izturīgu pret koroziju un daudz ko citu efektīvs.
Kur atrodams niobijs?
Salīdzinot ar citām dabā esošajām vielām, niobija koncentrācija ir zema - 24 daļas uz miljonu.
Šis metāls ir sastopams šādās valstīs: Brazīlijā, Kanādā, Austrālijā, Ēģiptē, Kongo Demokrātiskajā Republikā, Grenlandē, Krievijā, Somijā, Gabonā un Tanzānijā.
Niobijs Brazīlijā
1950. gados Brazīlijas ģeologs Djalma Guimarães atklāja Brazīlijas lielāko pirohloras rūdas atradni, kurā bija šis metāls.
Liels daudzums rūdu, kas satur niobiju, atrodas Brazīlijā, pasaulē lielākajā ražotājā, kurai pieder vairāk nekā 90% no metāla rezerves.
Izpētītās rezerves atrodas Minas Gerais, Amazonas, Goiás un Rondônia štatos.
niobija rūdas
Niobijs dabā sastopams vienmēr saistīts ar citiem ķīmiskajiem elementiem. Jau ir zināmas vairāk nekā 90 minerālu sugas, kas dabā satur niobiju un tantalu.
Zemāk esošajā tabulā mēs varam redzēt dažas no rūdām, kas satur niobiju, galvenās īpašības un katrā materiālā pieejamo niobija saturu.
| kolumbīta tantalīts | |
|---|---|
 | |
| Sastāvs: | (Fe, Mn) (Nb, Ta)2O6 |
| Niobija saturs (maksimums): | 76% no Nb2O5 |
| Iespējas: |
|
| Pirohlorīts | |
|---|---|
 | |
| Sastāvs: | (Plkst2,Šeit)2(Nb, Ti) (O, F)7 |
| Niobija saturs (maksimums): | 71% no Nb2O5 |
| Iespējas: |
|
| Loparīte | |
|---|---|
 | |
| Sastāvs: | (C, Na, C)2(Ti, Nb)2O6 |
| Niobija saturs (maksimums): | 20% no Nb2O5 |
| Iespējas: |
|
niobija izpēte
Niobija rūdas tiek pārveidotas, līdz tiek izveidoti produkti, kas tiks tirgoti.
Procesa darbības var apkopot šādi:
- Kalnrūpniecība
- Niobija koncentrācija
- Niobija rafinēšana
- Niobija produkti
Ieguve notiek tur, kur ir rūdas rezerves, kuras iegūst, izmantojot sprāgstvielas, un ar jostām transportē uz vietu, kur notiek koncentrācijas posms.
Koncentrācija notiek, sadaloties rūdai, slīpējot rūdas kristāli kļūst daudz smalkāki un izmantojot magnētiskā atdalīšana dzelzs frakcijas tiek noņemtas no rūdas.
Nafija attīrīšanā tiek noņemts sērs, ūdens, fosfors un svins.
Viens no produktiem, kas satur niobiju, ir dzelzs-niobija sakausējums, ko ražo saskaņā ar šādu vienādojumu:
Šo procesu sauc par aluminotermiju, kurā rūdas koncentrātu reaktoros sajauc ar dzelzs lūžņiem vai dzelzs oksīdu.
Metāla oksīdi reaģē ar alumīniju augstā temperatūrā, radot interesējošo produktu.
Visvairāk komerciālie niobija produkti ir:
- Niobija koncentrāti: bāze, kas satur 58% Nb2O5.
- Dzelzs-niobija sakausējums: satur 65% niobija.
- Augstas tīrības oksīds: izmanto īpašu materiālu ražošanā.
Kam domāts niobijs?
Niobija īpašības padara šo elementu arvien vēlamāku un ar neskaitāmiem pielietojumiem.
Kopš tā atklāšanas 1905. gadā sāka pētīt pieteikumus niobijam, kad vācu ķīmiķis Verners fon Boltons ražoja šo elementu tīrā veidā.
50. gadi bija liels niobija pielietojumu meklējums, jo līdz tam tas netika ražots lielā apjomā.
Šajā periodā aukstais karš izraisīja interesi par šo metālu, ko izmantot aviācijas un kosmosa detaļās.
Zemāk ir saraksts ar niobija izmantošanas veidiem.
Metāla sakausējumi

Niobija pievienošana sakausējumam palielina tā sacietējamību, tas ir, spēju sacietēt, pakļaujot karstumam un pēc tam atdzesējot. Tādējādi materiālu, kas satur niobiju, var pakļaut īpašām termiskām apstrādēm.
Niobija afinitāte ar oglekli un slāpekli veicina sakausējuma mehāniskās īpašības, palielinot, piemēram, mehānisko izturību un izturību pret abrazīvu nodilumu.
Šie efekti ir izdevīgi, jo tie var paplašināt sakausējuma rūpniecisko pielietojumu.
Piemēram, tērauds ir metāla sakausējums, ko veido dzelzs un ogleklis. Niobija pievienošanai šim sakausējumam var būt priekšrocības:
- Automobiļu rūpniecība: ražo vieglāku un izturīgāku pret triecieniem automašīnu.
- Celtniecība: uzlabo tērauda metināmību un nodrošina kaļamību.
- Transporta cauruļvadu nozare: Ļauj konstrukcijas ar plānākām sienām un lielāku diametru, neietekmējot drošību.
super sakausējumi

Super sakausējums ir metāla sakausējums ar augstu izturību pret augstām temperatūrām un mehānisko izturību. Sakausējumi, kas satur niobiju, padara šo materiālu noderīgu lidmašīnu turbīnu ražošanā vai enerģijas ražošanā.
Darbības augstā temperatūrā priekšrocība liek superakausējumiem sastādīt augstas veiktspējas reaktīvos dzinējus.
supravadoši magnēti

Niobija supravadītspēja izraisa niobija-germānija, niobija-skandija un niobija-titāna savienojumu izmantošanu:
- MRI aparātu skeneris.
- Daļiņu paātrinātāji, piemēram, lielais hadronu kolektors.
- Elektromagnētiskā starojuma noteikšana un kosmiskā starojuma izpēte ar materiāliem, kas satur niobija nitrītu.
Oksīdi
Citi niobija pielietojumi ir oksīdu, galvenokārt Nb, formā2O5. Galvenie izmantošanas veidi ir:
- optiskās lēcas
- Keramikas kondensatori
- pH sensori
- motora daļas
- Juvelierizstrādājumi
Niobija vēsture un atklājumi
1734. gadā dažas rūdas, kas piederēja Džona Vintropa personīgajai kolekcijai, tika aizvestas no Amerikas uz Angliju, un šie priekšmeti bija daļa no Londonas Britu muzeja kolekcijas.
Pievienojoties Karaliskajai biedrībai, britu ķīmiķis Čārlzs Hačets pievērsās muzejā pieejamo rūdu sastāva izpētei. Tā viņš 1801. gadā izolēja ķīmisko elementu oksīda veidā un nosauca to par kolumbiju un rūdu, no kura tas tika iegūts.
1802. gadā zviedru ķīmiķis Anderss Gustafs Ekebergs ziņoja par jauna ķīmiskā elementa atklāšanu un nosauca to par tantalu, atsaucoties uz Zeva dēlu grieķu mitoloģijā.
1809. gadā angļu ķīmiķis un fiziķis Viljams Haids Volastons analizēja šos divus elementus un novēroja, ka tiem ir ļoti līdzīgas īpašības.
Šī fakta dēļ no 1809. līdz 1846. gadam kolumbijs un tantals tika uzskatīti par vienu un to pašu elementu.
Vēlāk vācu mineralogs un ķīmiķis Heinrihs Rouzs, pētot kolumbīta rūdu, atzīmēja, ka klāt ir arī tantals.
Rouzs atrada cita elementa klātbūtni, līdzīgu tantālam, un nosauca to par Niobiusu, atsaucoties uz grieķu mitoloģijā esošo Tantala meitu Niobu.
1864. gadā zviedram Kristianam Bromstrandam izdevās izolēt niobiju no hlorīda parauga, kas uzkarsēts ūdeņraža atmosfērā.
Tīras un lietišķās ķīmijas savienība (IUPAC) 1950. gadā apstiprināja niobiju kā oficiālo nosaukumu, nevis kolumbiju, jo tie bija viens un tas pats ķīmiskais elements.
Niobija kopsavilkums
Ķīmiskais elements: niobijs | |||
|---|---|---|---|
| Simbols | Nb | Atklājējs | Čārlzs Hačets |
| atomu skaitlis | 41 | atomu masa | 92 906 u |
| Grupa | 5 | Laika kurss | 5 |
| Klasifikācija | pārejas metāls | Eletroniskais sadalījums | [Kr] 4d35s2 |
| Iespējas |
|
||
| Galvenās rūdas |
|
||
| Galvenie produkti |
|
||
| lietojumprogrammas |
|
||
| Notikums | Pasaulē |
|
|
| Brazīlijā |
|
Enem vingrinājumi un iestājeksāmeni
1. (Enem / 2018) Grieķu mitoloģijā Niobija bija Tantalas meita, divas rakstzīmes, kas pazīstamas ar ciešanām. Ķīmiskajam elementam ar atoma skaitli (Z), kas vienāds ar 41, ir ķīmiskās un fizikālās īpašības, kas ir tik līdzīgas elementam ar atoma numuru 73, ka tos sajauca.
Tāpēc par godu šiem diviem grieķu mitoloģijas varoņiem šiem elementiem tika piešķirti niobija (Z = 41) un tantala (Z = 73) nosaukumi. Šie divi ķīmiskie elementi ir ieguvuši lielu ekonomisko nozīmi metalurģijā, metālapstrādē supravadītājiem un citās augstas klases rūpniecības lietojumprogrammās, tieši ķīmisko un fizikālo īpašību dēļ kopīgs abiem.
KEAN, S. Pazūdošā karote: un citi patiesi trakuma, mīlestības un nāves stāsti no ķīmiskiem elementiem. Riodežaneiro: Zahar, 2011 (pielāgots).
Šo elementu ekonomiskā un tehnoloģiskā nozīme to ķīmisko un fizikālo īpašību līdzības dēļ ir saistīta ar:
a) elektroniem jābūt f apakšlīmenī.
b) būt iekšējas pārejas elementiem.
c) pieder pie vienas periodiskās tabulas grupas.
d) to attālākie elektroni ir attiecīgi 4. un 5. līmenī.
e) jāatrodas attiecīgi sārmainās zemes un sārmu ģimenē.
Pareiza alternatīva: c) pieder pie vienas periodiskās tabulas grupas.
Periodiskā tabula ir sakārtota 18 grupās (ģimenēs), kur katra grupa apvieno ķīmiskos elementus ar līdzīgām īpašībām.
Šīs līdzības notiek tāpēc, ka grupas elementiem valences apvalkā ir vienāds elektronu skaits.
Veicot elektronisko izplatīšanu un pievienojot elektronus no visenerģiskākā apakšlīmeņa līdz visattālākajam, mēs atrodam grupu, kurai pieder abi elementi.
| Niobijs | |
|
Izplatīšana elektronika |
1.s2 2s2 2. lpp6 3s2 3p6 4s2 3d10 4p65s2 4.d3 |
|
summa elektroni |
enerģiskāks + ārējs 4.d3 + 5s2 = 5 elektroni |
| Grupa | 5 |
| Tantāls | |
|
Izplatīšana elektronika |
1.s2 2s2 2. lpp6 3s2 3p6 4s2 3d10 4p6 5s2 4.d10 5. lpp66s2 4.f145.d3 |
|
summa elektroni |
enerģiskāks + ārējs 5.d3 + 6s2 = 5 elektroni |
| Grupa | 5 |
Elementi niobijs un tantals:
- Viņi pieder pie vienas periodiskās tabulas grupas.
- Viņu visattālākie elektroni atrodas attiecīgi 5. un 6. līmenī, un tāpēc tie atrodas 5. un 6. periodā.
- Viņiem ir elektroni d apakšlīmenī, un tāpēc tie ir pārejas elementi ārpusē.
2. (IFPE / 2018) Brazīlija ir pasaulē lielākā niobija ražotāja, kas veido vairāk nekā 90% no šī metāla rezerves. Niobijs, simbols Nb, tiek izmantots īpašu tēraudu ražošanā un ir viens no izturīgākajiem metāliem pret koroziju un ārkārtēju temperatūru. Nb savienojums2O5 tas ir gandrīz visu sakausējumu un niobija savienojumu priekštecis. Atzīmējiet alternatīvu ar nepieciešamo Nb masu2O5 lai iegūtu 465 gramus niobija. Dots: Nb = 93 g / mol un O = 16 g / mol.
a) 275 g
b) 330 g
c) 930 g
d) 465 g
e) 665 g
Pareiza alternatīva: e) 665 g
Niobija prekursors ir Nb oksīds2O5 un sakausējumos izmantotais niobijs ir elementārajā formā Nb.
Tāpēc mums ir šādas stehiometriskas attiecības:
1 mols Nb2O5 ģenerē 2 molus Nb, jo niobija oksīdu veido 2 šī metāla atomi.
1. solis: aprēķiniet saražotā niobija molu skaitu, kas atbilst 465 g.
Ja pēc aprēķina mēs redzējām, ka niobija masa atbilst 5 moliem, tad Nb molu skaits2O5 izmantotā puse ir puse no šīs vērtības, jo:
2. solis: aprēķiniet niobija oksīda molāro masu.
3. solis: aprēķiniet niobija oksīda masu, kas atbilst 2,5 mol.
3. (UECE / 2015) Brazīlijai pieder 98% no pasaules niobija rezervēm, kurām ir daudz rūpniecisku pielietojumu, piemēram, piemēram, juvelierizstrādājumu ražošanā, hiperalerģiski implanti, elektrokeramika, supravadoši magnēti, magnētiskās rezonanses mašīnas, metāla sakausējumi, īpašas monētas un tērauds. Attiecībā uz niobiju pārskatiet zemāk esošos apgalvojumus un atzīmējiet vienīgo patieso alternatīvu.
a) Tā diferenciālais elektrons atrodas priekšpēdējā apvalkā.
b) tas ir reprezentatīvs elements.
c) tā elektronegativitāte ir mazāka nekā vanādija.
d) tas pieder periodiskās tabulas ceturtajam periodam.
Pareiza alternatīva: a) tā diferenciālais elektrons atrodas priekšpēdējā apvalkā.
Veicot niobija elektronisko izplatīšanu, ir iespējams redzēt, ka tā diferenciālais elektrons atrodas priekšpēdējā apvalkā.
Tā kā tam ir diferenciālais elektrons d apakšlīmenī, tas ir ārējs pārejas elements.
Tā kā tā visattālākais līmenis ir piektajā slānī, niobijs atrodas tabulas piektajā periodā.
Elektronegativitāte ir īpašība, kas saistīta ar elementa spēju piesaistīt elektronus, un tā mainās atkarībā no atoma rādiuss: jo mazāks atoma rādiuss, jo lielāka ir elektronu piesaiste, un tāpēc lielāks elektronegativitāte.
Apskatot tabulu ar elektronegativitātes vērtībām, var redzēt, ka niobijam un vanādijam vērtības ir tuvu 1,6 Pauling.
4. (UEA / 2014) Niobija dabiskais izotops ir 93Nb. Neitronu skaits šajā izotopā ir
a) 41.
b) 52.
c) 93.
d) 134.
e) 144.
Pareiza alternatīva: b) 52.
Izotopi ir ķīmiskā elementa atomi ar dažādiem masas skaitļiem.
Atomu masa atbilst elementa protonu un neitronu summai.
Protonu skaits apzīmē ķīmiskā elementa atomu skaitu, un izotopiem tas nemainās.
Tādējādi izotopu masas variācijas notiek atšķirīgā neitronu skaita dēļ.
Ja niobija atomu skaits ir 41, tad neitronu skaitu norāda aprēķins:
5. (IFMG / 2015) Ķīmiskais elements niobijs, Nb, ir nosaukts grieķu dievietes Niobes vārdā. Brazīlija ir pasaulē lielākā metāla ražotāja, kas saražo 75% no produkcijas. Sakarā ar sakausējumu termisko stabilitāti, niobiju izmanto īpašu augstas stiprības tērauda sakausējumu ražošanai motoriem, vilces iekārtām un dažādiem supravadītājiem. Vērojot niobija stāvokli periodiskajā tabulā, ir pareizi apgalvot, ka:
a) jūsu enerģiskākais apakšlīmenis būs apakšlīmenis d.
b) ir elements, kas pieder sārmu metālu ģimenei.
c) veido jonu savienojumus ar citiem metāliem.
d) tā katjonu atoma rādiuss būs lielāks nekā tīrā elementa.
Pareiza alternatīva: a) jūsu enerģiskākais apakšlīmenis būs apakšlīmenis d.
Aplūkojot periodisko tabulu, mēs varam redzēt, ka niobiju raksturo kā ārēju pārejas elementu, kas pieder periodiskās tabulas 5. grupai, jo tā enerģiskākais apakšlīmenis ir d.
Mēs varam arī iegūt šo informāciju, izplatot to elektroniski.
Tā kā tas ir metāls, šis elements veido metāla savienojumus ar citiem metāliem, tāpat kā sakausējumā dzelzs-niobija vai arī kovalentās saites, daloties elektronos, tāpat kā niobija oksīdā Nb2O5.
6. (UFSC / 2003) Niobiju 1801. gadā atklāja angļu ķīmiķis Čārlzs Hačets. Brazīlijā pieder aptuveni 93% no pasaules niobija koncentrāta produkcijas. Lielākie noguldījumi atrodas Minas Gerais, Goiás un Amazonas štatos. Metālu galvenokārt izmanto dzelzs-niobija sakausējumu un citu sarežģītāku sakausējumu ražošanā, kas ir izmantoti reaktīvo dzinēju turbīnu, raķešu un kosmosa kuģu konstrukcijā. Tās oksīdus izmanto, lai ražotu gaismas lēcas brillēm, fotokamerām un citām optiskām iekārtām. Dots (Z = 41). Attiecībā uz niobiju atzīmējiet PAREIZO (-os) priekšlikumu (-us).
(01) Niobijs, zaudējot 3 elektronus, pieņem kriptona konfigurāciju.
(02) Niobijs var veidot M veida metāla oksīdus2O5 iekšā2O3.
(04) Niobija ķīmiskais simbols ir Ni.
(08) Niobijs ir pārejas metāls.
(16) Dzelzs-niobija sakausējums ir cieta šķīduma piemērs.
Pareizas alternatīvas: 02 + 08 + 16 = 26.
(01) NEPAREIZI.
| Elementi | Eletroniskais sadalījums |
| 36Kr | 1.s2 2s2 2. lpp6 3s2 3p6 4s2 3d10 4p6 |
|
41Nb 41Nb3+ |
1.s2 2s2 2. lpp6 3s2 3p6 4s2 3d10 4p6 5s2 4.d3 1.s2 2s2 2. lpp6 3s2 3p6 4s2 3d10 4p6 4p6 4.d2 |
(02) PAREIZI
Ņemot vērā niobija 3+ un 5+ oksidācijas skaitļus, tas var veidot savienojumus:
| Oksidācijas skaitlis 5+ | Oksidācijas numurs 3+ |
| Nb2O5 | Nb2O3 |
(04) NEPAREIZI
Ni ir niķeļa elementa simbols. Niobija simbols ir Nb.
(08) PAREIZI
Niobijs ir ārējs pārejas metāls, kas pieder periodiskās tabulas 5. grupai.
(16) PAREIZI
Ciets šķīdums atbilst divu vai vairāku sastāvdaļu maisījumam tajā pašā fāzē, kas ir ciets un ir izplatīts starp metāliem.
7. (UERJ / 2013) Niobijs ir metāls, kas atrodas dabīgās nogulsnēs, galvenokārt oksīdu veidā.
Depozītā, kas satur niobiju ar oksidācijas skaitli +5, šī metāla dominējošā oksīda formula atbilst:
a) NbO5
b) Nb5O
c) Nb5O2
d) Nb2O5
Pareiza alternatīva: d) Nb2O5
Skābeklis izveido divas saites un tam ir noteikts oksidācijas skaitlis, kas ir 2-.
Tāpēc, lai izveidotu niobija oksīdu, skābeklim ir jāsaista ar 2 šī metāla atomiem.
Niobijam ir dažādi oksidācijas stāvokļi. Ar oksidācijas numuru 3+ tas saistās ar 3 oksigēniem un ar Nox 5+ veido savienojumu: Nb2O5 kur 2 niobija atomi saistās ar 5 skābekļa atomiem.
Izlasiet tekstu, lai atbildētu uz 8. līdz 10. jautājumu.
Niobijs ir metāls, kam ir ļoti liela tehnoloģiska nozīme, un tā galvenās pasaules rezerves atrodas Japānā
Brazīlija pirohlora rūdas formā, kas sastāv no Nb2O5. Vienā no tās ekstraktīvās metalurģijas procesiem aluminotermiju izmanto Fe oksīda klātbūtnē2O3, kā rezultātā blakusprodukts ir niobija un dzelzs un alumīnija oksīda sakausējums. Šī procesa reakcija ir attēlota vienādojumā:
Dabā niobijs parādās stabila izobija niobija-93 formā, taču ir zināmi vairāki nestabili sintētiskie izotopi, kas sadalās, izstarojot radiāciju. Viens no tiem ir niobijs-95, kas sadalās līdz molibdēna-95 elementam.
(Systems.dnpm.gov.br; Tehnoloģija Metāls. Mater. Miner., Sanpaulu, v. 6, Nr. 4. lpp. 185-191, apr.-jūnijs. 2010. un G. Audi u.c. / Kodolfizika A 729 (2003) 3–128. Pielāgots)
8. (FGV / 2019) Aluminotermijas reakcijā, lai iegūtu niobija un dzelzs sakausējumu, ņemot vērā līdzsvarotajā vienādojumā sniegto stehiometriju, kopējais procesā iesaistīto elektronu skaits ir
a) 6.
b) 12.
c) 18.
d) 24.
e) 36.
Pareiza alternatīva: e) 36.
Redoksa reakcija notiek ar elektronu zudumu un pieaugumu.
Kad elements samazinās, tas iegūst elektronus un, kad elements oksidējas, tas zaudē elektronus.
Kad elements samazinās, tas ir oksidētājs, turpretī, kad elements oksidējas, tas ir reducētājs.
Tādā veidā elektronu skaits, kurus viens elements zaudēja un atdeva citam, ir vienāds.
| Elements | NOX | Reakcija | elektroni | |
| Niobijs |
+5 3Nb2O5 |
0 6Nb |
Samazināšana | 3.2.5 = 30 un- ieguvumi |
| Dzelzs |
+3 Ticība2O3 |
0 2Fe |
Samazināšana | 2,3 = 6 un- ieguvumi |
| Alumīnijs |
0 12Al |
+3 6Al2O3 |
Oksidēšana | 6.2.3 = 36 un- zaudēja |
Alumīnija oksīda izstrādājuma alumīnija lādiņš ir 3+, tas ir, katrs alumīnijs ir zaudējis 3 elektronus.
Bet produktos mums ir 12 alumīnija atomi, kas veido kopējo šajā procesā iesaistīto elektronu skaitu:
12. 3 = 36 elektroni.
9. (FGV / 2019) Aluminotermiskā operācijā niobija un dzelzs sakausējuma ar stehiometrisku daudzumu Nb ražošanai2O5 un Fe2O3 un izmantojot lieko metāla alumīniju, izveidojās 6,12 tonnas Al.2O3. Tiek aprēķināts, ka šajā darbībā iegūto niobija un dzelzs kopējais daudzums molos ir mols
a) 6 × 104
b) 6 × 106
c) 8 × 103
d) 8 × 104
e) 8 × 106
Pareiza alternatīva: d) 8 × 104.
1. solis: aprēķina Al molāro masu2O3
2. solis: aprēķiniet Al molu skaitu2O3
3. solis: veiciet stehiometriskās attiecības.
Ķīmiskajā vienādojumā mēs redzam, ka pastāv sakarība: 6 molus niobija, 6 molus alumīnija un 2 molus dzelzs.
Pēc izveidoto molu skaita attiecības mums ir:
Niobija un dzelzs daudzums molos ir:
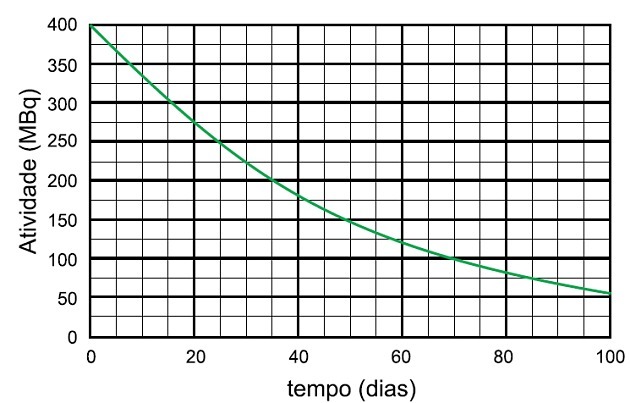
Niobija-95 radioizotopu sabrukšanas procesā tiek noteikts laiks, kas vajadzīgs, lai šī parauga darbība sabruktu līdz 25 MBq, un izstarotās sugas nosaukums ir
a) 140 dienas un neitroni.
b) 140 dienas un protoni.
c) 120 dienas un protoni.
d) 120 dienas un daļiņas ß–.
e) 140 dienas un daļiņas ß–.
Pareiza alternatīva: e) 140 dienas un daļiņas ß–.
Pusperiods ir laiks, kas nepieciešams radioaktīvā parauga aktivitātes samazināšanai uz pusi.
Grafikā mēs redzam, ka radioaktīvā aktivitāte sākas ar 400 MBq, tāpēc pussabrukšanas periods ir laiks, kas vajadzīgs, lai aktivitāte sadalītos līdz 200 MBq, kas ir puse no sākotnējās.
Diagrammā analizējam, ka šis laiks bija 35 dienas.
Lai aktivitāte atkal samazinātos uz pusi, pagāja vēl 35 dienas un aktivitāte no 200 MBq līdz 100 MBq, kad pagāja vēl 35 dienas, tas ir, no 400 līdz 100 MBq 70 dienas.
Lai paraugs sadalītos līdz 25 MBq, bija nepieciešami 4 pusperiodi.
Kas atbilst:
4 x 35 dienas = 140 dienas
Radioaktīvā sabrukumā emisijas var būt alfa, beta vai gamma.
Gamma starojums ir elektromagnētiskais vilnis.
Alfa emisijai ir pozitīvs lādiņš, un tā samazina 4 masas vienības un 2 vienības sabrukušā elementa atoma skaitā, pārvēršot to citā elementā.
Beta emisija ir ātrgaitas elektrons, kas par vienu vienību palielina sabrukušā elementa atomu skaitu, pārvēršot to citā elementā.
Niobija-95 un molibdēna-95 masa ir vienāda, tāpēc beta emisija radās, jo: