Vielu molekulas nav visas taisnas, it kā tās atrastos vienā plaknē. Galu galā tie ir izkaisīti telpā, un to atomi iegūst dažādus izvietojumus vai izkārtojumus. Tādējādi katra veida vielas molekulām ir dažādas ģeometriskās formas.
Viens no vienkāršākajiem veidiem, kā noteikt molekulas ģeometriju, ir balstīts uz teoriju par valences apvalka elektronu pāru atgrūšana (RPECV). Saskaņā ar šo teoriju centrālā atoma elektronu pāri funkcionē kā elektroniskie mākoņi kas atgrūž viens otru. Tādā veidā tie tiek orientēti pēc iespējas tālāk viens no otra. Molekulārā ģeometrija būs atkarīga no elektronisko pāru skaita ap centrālo atomu.
Šis elektroniskais mākonis var sastāvēt no elektroniem, kas piedalās saitēs (vienkāršā, dubultā vai trīskāršā), kā arī no tiem, kas nepiedalās. Tātad mums ir:
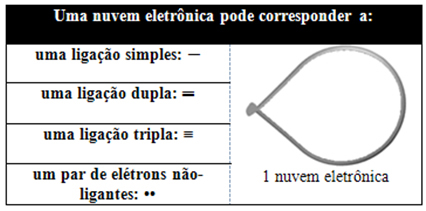
Tas palīdz domāt par šo mākoni kā piesietu balonu vai baloniem, kuru centrā ir centrālais atoms. Piemēram, molekulā, kurai ap centrālo atomu ir tikai divi elektronu mākoņi, jo lielāks iespējamais attālums starp tiem ir 180º leņķis, un līdz ar to molekulas ģeometrija būs lineārs.
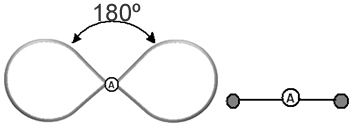
Tāpēc mēs varam izdarīt secinājumus par to, kāda būs lielākās daļas molekulu molekulārā ģeometrija, ja ņemsim vērā atomu skaitu molekulās un saites, ko veido centrālais atoms, pārbaudot, vai tam ir vai nav elektroni.
Skatiet tālāk sniegtos piemērus.
- Molekulas ar 2 atomiem: vienmēr būs lineārs
Piemēram:
H─H, H─Cl, F─F, O═O, C≡O.
Nepārtrauciet tagad... Pēc reklāmas ir vēl kas ;)
- 3 atomu molekula: leņķa vai trīsstūrveida
ja centrālais atoms piemīt nesaistošu elektronu pāris ģeometrija būs leņķisks, tāpat kā SO molekulas gadījumā2:
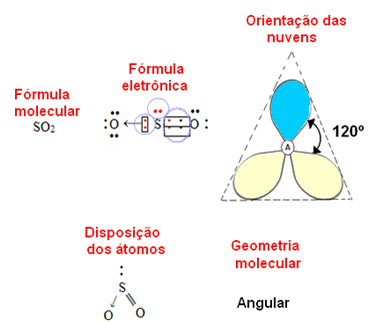
Uzskatiet, ka zilais elektronu mākonis attēlo elektronu pārus, kas nepiedalās saitēs, un dzeltenais ir elektronu pāri, kas piedalās saitēs.
- 4 atomu molekula: plakne trigonāla (vai trīsstūrveida) vai piramīda (vai trigonāla piramīda)
Ja centrālajam atomam nav nepāra (nesaistīta) elektronu pāra, molekulārā ģeometrija ir plakana trigonāla (vai trīsstūrveida). Apskatiet BF piemēru3:

Ja atomam ir nesaistoši elektronu pāri, molekulas ģeometrija būs piramīda (vai trigonāla piramīda), kā tas ir amonjaka gadījumā:

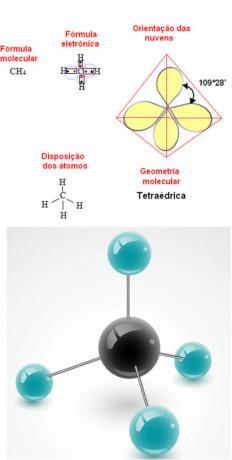
- 5 atomu molekula: tetraedrisks
Metāna ģeometrijas piemērs:
- Molekula ar 6 atomiem: trigonāla bipiramīda vai trīsstūrveida piramīda.
Piemērs ir fosfora pentahlorīds (PCl5), kam ir daži savienojumi starp fosforu un hloru 90º leņķī un citi 120º leņķī, veidojot bipiramīdu ar trīsstūrveida pamatni:
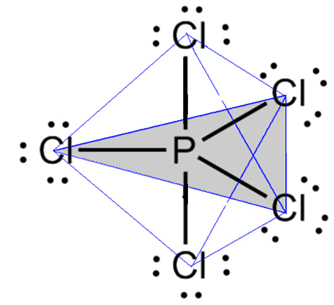
- 7 atomu molekula: oktaedrisks
Piemērs: sēra heksafluorīds (SF6), kuras leņķi ir 90º.

Autore: Dženifera Fogača
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu kādā skolā vai akadēmiskajā darbā? Skaties:
FOGAÇA, Dženifera Roča Vargasa. "Molekulu ģeometrijas noteikšana"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm. Skatīts 2021. gada 27. jūlijā.

