valences slānis tas ir atoma visattālākais slānis (vai līmenis) (vistālāk no kodola), tas ir, vistālāk no kodola. Tāpēc tam ir tā sauktie attālākie elektroni jeb valences elektroni.
Atoma līmeņu skaits var svārstīties no 1 līdz 7, kuriem ir šādas apakšlīmenis (dzeltenā krāsā):
K līmenis (1. slānis): apakšlīmenis s
L līmenis (2. slānis): apakšlīmenis s un P
M līmenis (3. slānis): apakšlīmenis s, P un d
N līmenis (4. slānis): apakšlīmenis s, P, d un f
O līmenis (5. slānis): apakšlīmenis s, P, d un f
P līmenis (6. līmenis): apakšlīmenis s, P un d
Q līmenis (1. slānis): apakšlīmenis s un P
Katrā no apakšlīmeņiem ir atšķirīgs elektronu skaits. Skaties:
apakšlīmenī s ir ne vairāk kā 2 elektroni;
apakšlīmenī p ir ne vairāk kā 6 elektroni;
d apakšlīmenī ir ne vairāk kā 10 elektroni;
f apakšlīmenī ir ne vairāk kā 14 elektroni.
Tādējādi, ja noteikta atoma valences apvalks ir M, maksimālais iespējamais elektronu skaits tajā ir 18 (2 elektroni no s apakšlīmeņa + 6 elektroni no p apakšlīmeņa + 10 elektroni no d) apakšlīmenis.
Lai noteiktu atoma valences apvalku un to, cik daudz tajā ir elektronu, ir divi veidi, proti:
→ Valences apvalka un tā elektronu skaita noteikšana no elektroniskās izplatīšanas
Elektroniskā izplatīšana vienmēr tiek veikta caur Linusa Paulinga diagramma, kas attēlots zemāk:

Linusa Polinga diagrammas attēlojums
Parasts atomu skaitlis (kas norāda elektronu skaitu atomā), mēs veicam elektronisko izplatīšanu. Piemēram, atoma skaitlis 50:

Elektroniskais atoma skaitļa atoma sadalījums ir vienāds ar 50
Analizējot iepriekš minēto sadalījumu, mums ir tas, ka attālums no kodola ir 5. (N līmenis), kurā mums ir 4 elektroni (divi s apakšlīmenī un 2 p apakšlīmenī).
→ Valences apvalka un tā elektronu skaita noteikšana no periodiskās tabulas
Tabula ir sakārtota periodos (horizontālās kolonnas), kas norāda atoma līmeņu skaitu un grupas vai saimes (vertikālās kolonnas). Periodu izmanto, lai noteiktu valences slānis, un ģimenes tiek izmantotas, lai noteiktu elektronu skaitu.
a) Zinot ķīmiskā elementa periodu
Periodiskajā tabulā ir parādīti kopumā septiņi periodi, kuru skaits ir saistīts ar līmeņu skaitu, kas atrodas Linusa Paulinga diagrammā. Tātad, ja mēs zinām periodu, kurā ķīmiskais elements tas ir tabulā, automātiski, mēs zinām, cik daudz līmeņu ir jūsu atomiem, valences slānim atrodoties vistālāk no kodola.
1. piemērs: ķīmiskais elements Kālijs
Kālijs ir izvietots periodiskās tabulas ceturtajā periodā, tāpēc tā atomam ir četri līmeņi, ceturtais līmenis ir valences slānis, kas tiek apstiprināts ar tā sadalījumu elektronika.
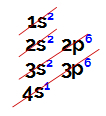
Elektroniska kālija izplatīšana
2. piemērs: ķīmiskais elements Fluors
Fluors atrodas Periodiskās tabulas otrajā periodā, tāpēc tā atomam ir divi līmeņi, otrais līmenis ir valences slānis, kas tiek apstiprināts ar tā sadalījumu elektronika.

Fluora elementa elektroniska izplatīšana
3. piemērs: Indija ķīmiskais elements
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Indietis atrodas Periodiskās tabulas piektajā periodā, tāpēc viņa atomam ir pieci līmeņi, piektais līmenis ir valences slānis, kas tiek apstiprināts ar tā sadalījumu elektronika.

Indium elementa elektroniska izplatīšana
b) Zinot ķīmiskā elementa saimi vai grupu
Zinot ģimeni vai grupu, kurā elements atrodas, mēs zinām arī šī elementa valences apvalkā esošo elektronu skaitu.
A ģimenes elementi
A ģimeņu elementi ir izvietoti periodiskās tabulas 1., 2., 13. līdz 18. slejā. Katra no šīm kolonnām saņem skaitli (no 1 līdz 8, romiešu cipars), kas precīzi norāda elektronu skaitu šo elementu valences apvalkā:
1. kolonna - IA saime = visiem valences apvalkā ir 1 elektrons;
2. kolonna - IIA ģimene = visiem valences apvalkā ir 2 elektroni;
3. kolonna - IIIA saime = visiem valences apvalkā ir 3 elektroni;
4. kolonna - IVA saime = visiem valences apvalkā ir 4 elektroni;
5. kolonna - VA saime = visiem valences apvalkā ir 5 elektroni;
6. kolonna - VIA saime = visiem valences apvalkā ir 6 elektroni;
7. kolonna - VIIA ģimene = visiem valences apvalkā ir 7 elektroni;
8. kolonna - VIIIA saime = visiem valences apvalkā ir 8 elektroni.
Skatiet dažus A grupas dažu elementu valences elektronu skaita noteikšanas piemērus:
1. piemērs: ķīmiskais elements bārijs
Bārijs atrodas IIA ģimenē, tāpēc valences apvalkā tam ir divi elektroni, ko apstiprina tā elektroniskā izplatīšana:

Bārija elementa elektroniska izplatīšana
2. piemērs: Antimona ķīmiskais elements
Antimons atrodas VA ģimenē, tāpēc tā valences apvalkā ir pieci elektroni, ko apstiprina tā elektroniskā izplatīšana:

Antimona elementa elektroniska izplatīšana
3. piemērs: Ksenona ķīmiskais elements
Ksenons atrodas VIIIA ģimenē, tāpēc tā valences apvalkā ir astoņi elektroni, ko apstiprina tā elektroniskā izplatīšana.

Ksenona elementa elektroniska izplatīšana
PIEZĪME: vienīgais A ģimenei piederošais ķīmiskais elements, kas neatbilst ierosinātajam noteikumam, ir hēlijs. Tas pieder pie VIIIA saimes, bet valences apvalkā ir tikai divi elektroni. Tas ir tāpēc, ka tā atomu skaitlis ir 2, tāpēc nav iespējams, lai tā valences apvalkā būtu 8 elektroni, tāpat kā pārējie ģimenes elementi.
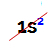
Elektroniska hēlija atoma izplatīšana
B ģimenes elementi
B saimes elementi ir izvietoti periodiskās tabulas 3. līdz 12. kolonnā. Papildus A ģimenēm ir arī astoņas B ģimenes, kuras apzīmē ar romiešu cipariem. Atšķirībā no A ģimenēm, B ģimenes skaits nenosaka elektronu skaitu valences apvalkā.
Elektronu skaits B saimes elementa valences apvalkā vienmēr ir vienāds ar 2, neatkarīgi no atomu skaita un stāvokļa tabulā. Kalifornija elektroniskā izplatīšana (98Cf) un hassius (108hs) pierādi to:
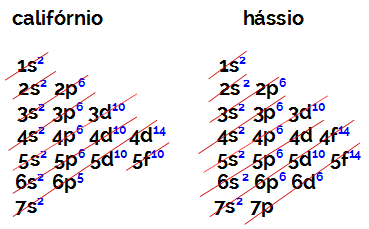
Kalifornija elektroniskajai izplatīšanai kā enerģētiskākajai apakšlīmeņai ir 5f10, un hassius o ir 6d6. Abos gadījumos apakšlīmenis, kas atrodas vistālāk no kodola, ir septītais līmenis, un abiem ir divi sadalīti elektroni.
Autors: Diogo Lopes Dias
