Dažiem savienojumiem, lai sasniegtu stabilitāti, valences apvalkā nav jābūt astoņiem elektroniem, tāpēc tos uzskata par okteta noteikuma izņēmumiem. Uzziniet tagad, kāpēc daži elementi izvairās no pienākuma pēdējā elektronā saturēt elektronu oktetu.
Berilijs (Be)
Tas ir izņēmums no astoņpadsmitās kārtulas, jo tas spēj veidot savienojumus ar divām atsevišķām saitēm, tāpēc tas stabilizējas tikai ar četriem elektroniem valences apvalkā. 
Tā kā ūdeņradim (H) ir jāatsakās no diviem elektroniem, lai izveidotu saiti (H - Nu - H), berilija (Be) atoms dalās ar saviem elektroniem un sasniedz stabilitāti.
Alumīnijs (Al)
Tas ir izņēmums no okteta likuma, jo tas sasniedz stabilitāti ar sešiem elektroniem valences apvalkā. Alumīnija atoms mēdz ziedot savus elektronus un tādējādi var izveidot trīs atsevišķas saites ar citiem atomiem: 
Šajā gadījumā alumīnijs (Al) izveidoja trīs saites ar trim fluora (F) atomiem.
Bors (B)
Tas veido molekulāras vielas ar trim atsevišķām saitēm. 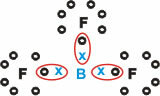
Ņemiet vērā, ka bors (B) mēdz ziedot savus elektronus fluora (F) atomiem, kas pakļaujas okteta likumam, un valences apvalkā nepieciešami astoņi elektroni. Kad bors atsakās no elektroniem, fluors stabilizējas ar izveidoto oktetu.
Autore Líria Alves
Beidzis ķīmiju
Brazīlijas skolu komanda
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Redzēt vairāk!
Okteta teorija
Vispārīgā ķīmija - Ķīmija - Brazīlijas skola
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
SOUZA, Líria Alves de. "Astoņnoteikuma izņēmumi"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm. Piekļuve 2021. gada 27. jūnijam.