Katalizatori ir vielas, kas spēj paātrināt reakciju, nemainoties, tas ir, tās netiek patērētas reakcijas laikā.
Lai saprastu, kā darbojas katalizatori, mums jāatceras, kas tika paskaidrots tekstā "Aktivizācijas enerģija”. Kā parādīts tur, lai sāktos ķīmiskā reakcija, reaģentiem ir vai ir jāsaņem noteikts minimālās enerģijas daudzums, ko sauc par aktivācijas enerģija.
Ar šo minimālo enerģiju reaģenti spēj sasniegt komplekss aktivizēts, kas ir starpstāvoklis (pārejas stāvoklis), kas veidojas starp reaģentiem un produktiem, kurā - struktūrā pastāv novājinātās iepriekšējās saites un jaunu saišu veidošanās (kas atrodas produkti).
Piemēram, apsveriet tālāk minēto vispārīgo reakciju:
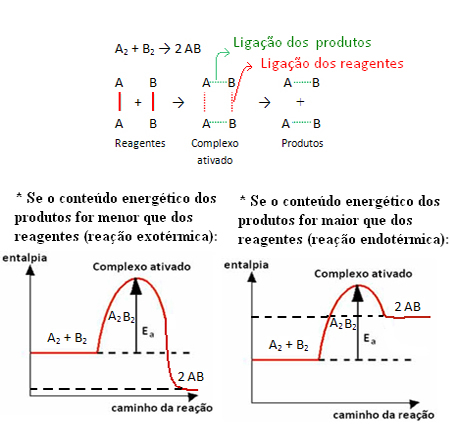
Ņemiet vērā, ka aktivācijas enerģija, kas vajadzīga, lai sasniegtu aktivēto kompleksu, kļūst par sava veida šķērsli, kas jāpārvar, lai notiktu reakcija. Tas nozīmē, ka jo lielāka reakcijas aktivācijas enerģija, jo lielāks šķērslis jāpārvar un jo lēnāks reakcijas ātrums.
Tāpat ir tieši pretēji, ja aktivācijas enerģija ir mazāka, reakcija būs ātrāka. Tas ir tieši tas
katalizatori vai viņi to dara tie rada alternatīvu ceļu, kas prasa mazāk aktivācijas enerģijas, liekot reakcijai ritēt ātrāk.Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)

Lai samazinātu aktivācijas enerģiju, katalizators darbojas, mainot reakcijas mehānismu, apvienojot ar reaģentiem sistēmā, kas var būt vienfāzes (homogēna katalīze) vai polifāziska (neviendabīga katalīze).
Sīkāka informācija par šiem katalīzes veidiem ir redzama zemāk esošajos tekstos:
- viendabīga katalīze
- neviendabīga katalīze
Bet, vispārīgi runājot, mēs varam teikt, ka tā reaģenta un katalizatora kombinācija veido starpproduktu savienojumu, kas pēc tam pārveidojas par produktu un katalizatoru. Ņemiet vērā, kā to var attēlot:
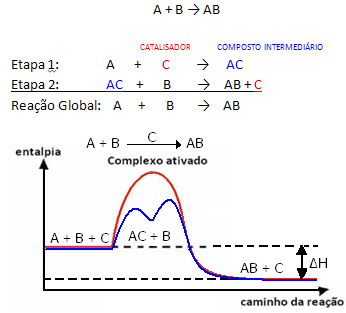
Redziet, ka reakcijas beigās katalizators tiek reģenerēts, nevis tas tiek patērēts.
Svarīgs fakts ir tas katalizators paātrina gan virzību uz priekšu, gan atpakaļgaitu, tas nozīmē, ka tas samazina abu aktivācijas enerģiju.
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Kā darbojas katalizējošās vielas?"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/como-atuam-as-substancias-catalisadoras.htm. Piekļuve 2021. gada 27. jūnijam.



