Oksidācijas-reducēšanās reakcijas, kas notiek ūdeņraža peroksīda (ūdeņraža peroksīda ūdens šķīduma - H2O2 (aq)) ir īpašs gadījums, kas jāanalizē atsevišķi, galvenokārt attiecībā uz tā līdzsvaru. Tas ir tāpēc, ka ūdeņraža peroksīdā esošie oksigēni, kuru Nox ir vienāds ar -1, var vai nu oksidēties, vai reducēties.
Piemēram, aplūkosim divus gadījumus, kad tas vispirms rīkojas kā oksidētājs (reducētājs) un pēc tam kā reducētājs (oksidētājs):
- oksidētājs: ikreiz, kad ūdeņraža peroksīds tiek reducēts, darbojoties kā oksidētājs, tas ražo ūdeni kā produktu.
Ja pievienojam ūdeņraža peroksīda šķīdumu šķīdumam, kas satur jodīda jonus (I-) skābā vidē mums būs:
H2O2 (aq) + Es-(šeit) + H+(šeit) → H2O(1) + Es2 (s)
Skatiet, ka veidojas ūdens un jods. Bet, lai pārbaudītu, vai ūdeņraža peroksīds faktiski darbojās kā oksidētājs un reducējās, ievērojiet oksidācijas skaitļu (NOx) noteikšanu: *

Ūdeņraža peroksīda skābekļa oksīds Nox samazinājās no -1 līdz -2, ņemot vērā, ka tas saņēma 1 elektronu. Tomēr, tā kā katrā ūdeņraža peroksīda molekulā (H2O2), Nox variācija būs vienāda ar 2.
Tātad, kā parādīts tekstā “Redoksa līdzsvarošana”, Nepieciešams solis reakciju līdzsvarošanai ar redoksa metodi ir Nox variāciju vērtību apgriešana ar koeficientiem, šajā gadījumā šādi:
* H2O2 = 2 (∆Nox) = 2 → 2 būs koeficients I-;
* Es-= ∆Nox = 1 → 1 būs H koeficients2O2.
Tādējādi mums ir:
1 stunda2O2 (aq) + 2 es-(šeit) + H+(šeit) → H2O(1) + Es2 (s)
Pārējo koeficientu sasniegšana, līdzsvarojot ar izmēģinājumiem:
- Tā kā 1. loceklī ir divi skābekļa atomi, 2. locekļa ūdens koeficientam jābūt vienādam ar 2. Tā kā 1. loceklī ir arī divi jodīdu joni, joda koeficients 2. loceklī būs 1. Neaizmirstiet, ka mums ir jāreizina indekss ar koeficientu, lai atrastu pareizo atomu un jonu daudzumu katrā loceklī:
1 stunda2O2 (aq) + 2 es-(šeit) + H+(šeit) → 2 H2O(1) + 1 es2 (s)
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
- Tagad atliek tikai līdzsvarot 1. locekļa ūdeņraža katjonu, un tā koeficientam būs jābūt vienādam ar 2, jo 2. loceklī tam ir 4 ūdeņraži un 1. loceklim jau ir divi:
1 stunda2O2 (aq) + 2 es-(šeit) +2 H+(šeit) → 2 H2O(1) + 1 es2 (s)
- reducētājs: ikreiz, kad ūdeņraža peroksīds oksidējas, darbojoties kā reducētājs, tas rada skābekli (O2) kā produktu.
Piemēram, ūdeņraža peroksīds reducējas, kad tas nonāk saskarē ar kālija permanganātu (KMnO4). Šai vielai ir ļoti raksturīga violeta krāsa, bet, nonākot saskarē ar ūdeņraža peroksīdu, tā kļūst bezkrāsaina. Tas ir tāpēc, ka visi MnO jonā esošie mangāni4- permanganāta šķīduma tiek samazināts, izraisot Mn jonu2+, kā parādīts zemāk:
+1 -1 +7 -2 +1 0 +2 +1 -2
H2O2 + MnO4-+ H+ →2 + Mn2++ H2O
Aprēķinot Nox, mēs redzam, ka skābeklis ūdeņraža peroksīdā faktiski oksidējas un izraisa mangāna samazināšanos:
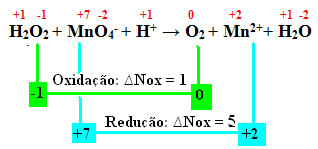
Tāpat kā iepriekšējā piemērā, ūdeņraža peroksīda oxNoks būs vienāds ar 2, jo ir divi oksigēni un katrs zaudē elektronu. Tāpēc mums ir:
* O2 = 2 (∆Nox) = 2 → 2 būs MnO koeficients4-;
* MnO4- = ∆Nox = 5 → 5 būs O koeficients2.
Un kā visi O2 nāk no ūdeņraža peroksīda, abām vielām ir vienāds koeficients:
5 H2O2 + 2MnO4-+ H+ → 5 O2 + Mn2++ H2O
Balansējot pēc izmēģinājuma metodes, mums ir:
5 stundas2O2 + 2 MnO4-+ 6 H+ → 5 O2 + 2 Mn2++ 8 H2O
* Par visiem jautājumiem par to, kā aprēķināt reakcijas atomu un jonu oksidācijas skaitli (Nox), lasiet tekstu “Oksidācijas skaitļa (NOx) noteikšana”.
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Oksidēšanās-reducēšanas reakcijas, kurās iesaistīts ūdeņraža peroksīds"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-envolvendo-agua-oxigenada.htm. Piekļuve 2021. gada 28. jūnijam.