Metāli ir elementi, ko raksturo spilgtums, izturība, siltuma un elektrovadītspēja. Viņi ir praktiski visos rūpnieciskajos procesos, klātbūtne metāla sakausējumos, ko izmanto instrumentu, rotaslietu un monētu ražošanā, un ķīmiskos procesos, piemēram, redoksā, kas atbild par kaudzes un baterijas.
Periodiskajā tabulā tos klasificē:
pusmetāli
pārejas metāli
sārmu metāli
sārmu zemes metāli
Tērauda rūpniecībā tos iedala:
melnie metāli
krāsainie metāli
smagie metāli
Lasiet arī: Kādi ir jaunie periodiskās tabulas elementi?
Metāla īpašības

Tie lielākoties ir lieliski siltuma un elektriskās enerģijas vadītāji.
Viņiem ir spīdīgs izskats.
ir augsts blīvums.
Tie ir elektropozitīvi elementi (tiem ir tendence veidot katjonus - pozitīvus lādiņus).
Izņemot Dzīvsudrabs, tie ir elementi ar augstu kušanas temperatūru un cieti istabas temperatūrā.
Viņiem ir mehāniskā izturība (izturība).
Tie ir kaļami (var veidot bez salaušanas).
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Periodiskās tabulas metāli
sārma metāli
Vai ir elementi periodiskās tabulas pirmā kolonna, 1.A saime. Tos sauc par sārmu metāliem, jo, sajaukti ar ūdeni, tie veido hidroksīdus, tas ir, sārmainu (bāzisku) šķīdumu.
Jūs elementi kas pieder šai grupai, ir:
Litijs li)
Nātrijs (Plkst.)
Kālijs (K)
Rubīdijs (Rb)
Cēzijs (Cs)
Francio (Fr)
Sārmu metālu elektroniskā konfigurācija neitrālā (neuzlādētā / jonizētā) stāvoklī ir tikai elektrons pēdējā apvalkā (valences slānis). O atomu stars un šo metālu reaktivitāte palielinās no augšas uz leju (novērojot Periodiskā tabula). Viņiem ir zema kušanas temperatūra salīdzinājumā ar citiem metāliem, tie ir kaļami un ne pārāk blīvi, tiem ir matēts augsts oksidēšanās potenciāls.
Skatīt arī:Kādas ir vielas īpašības?
sārmu zemes metāli
Tie ir elementi, kas parādās periodiskās tabulas otrā kolonna, 2.A saime. tiek saukti sārma zeme pēc tendences veidot pamata (sārmaina) šķīduma veidus un ar zemi, jo līdz 19. gadsimtam šādā veidā tika apzīmēti šo vielu radītie oksīdi. Šis termins tika izmantots, lai apzīmētu nešķīstošus metālus, kuriem karsējot nav notikušas mutācijas, 2. grupas elementu kopīgās īpašības. Vēlāk, ņemot vērā jaunus pētījumus un eksperimentus, tika atklāts, ka “zemes” elementi faktiski ir metālu veidoti oksīdi.
Tie ir kaļami metāli ar mazu blīvumu divi elektroni tā vistālākajā apvalkā, normālos temperatūras un spiediena apstākļos ir cietā stāvoklī. Pieder šai grupai:
Berilijs (Be)
Magnijs (Mg)
Kalcijs (Šeit)
Stroncijs (Mr)
Bārijs (Ba)
Radio (Varde)
pārejas metāli
veido periodiskās tabulas B grupaun atrodas starp sārmu zemes metāliem un ametals. IUPAC tos definēja kā elementus, kuriem ir nepilnīgs enerģētiskās apakšslānis. Termiņš "pārejas metāli" attiecas uz pāreja no 2. grupas uz 13. grupu periodiskajā tabulā un pieaugošo elektronu pievienošanu ‘d’ orbitālē.
Pārejas metālu grupa sastāv no blīviem elementiem, ar augstu kušanas un viršanas temperatūru, un mazāk reaktīvs nekā 1. un 2. grupas metāls (1.A un 2.A ģimene). Starp pārejas metāliem ir volframs, kas ir visaugstākā kušanas temperatūra (3422 ° C), un dzīvsudrabs (Hg), ir metāls, kas normālos temperatūras un spiediena apstākļos ir šķidrs, tā kušanas temperatūra ir (-38,83 ° C).
Pārejas metāliem ir dažādi oksidēšanās stāvokļi (NOX mainīgs) un veido krāsainas vielas.

Iekšējie pārejas elementi
Iekšējie pārejas elementi viņi ir:
Lantanīdi: sērija, kas sastāv no elementiem, kuriem ir no 57 līdz 71 protoniem un kas, izņemot prometiju, ir dabiski.
Aktinīdi: grupa, ko veido elementi, kuru atoma skaitlis svārstās no 89 līdz 103, un kuri lielākoties ir sintētiski. Visa šī grupa ir radioaktīvs ar īsu pussabrukšanas periodu.
Šo divu grupu elementiem ir augsta kušanas temperatūra, un tie visi ir cieti istabas temperatūrā.
Pusmetāli
Jūs pusmetāli kopumā ir septiņi elementi:
Bors (B)
Silīcijs (Si)
Ģermānijs (ge)
Arsēns (As)
Antimons (Pirmdiena)
Telūrs (Te)
Polonijs (Po)
Šī klasifikācija tiek piešķirta elementiem, kuriem ir fizikāli ķīmiskās īpašības, kas attiecas uz metāliem, kā arī citas, kas attiecas uz nemetāliskiem elementiem. Semimetāliem ir spīdums, tie ir trausli savienojumi, kas spēj veidot katjonus un arī anjonus (atkarībā no stāvokļa) un ir starpvadītāji.
Metālu veidi
Dzelzs: vielas, kuru sastāvā ir dzelzs. Viņi ir metāla sakausējumi kas kā kopīgu elementu satur dzelzi, bet tos var formulēt ar dažādu koncentrāciju ogleklis, piemēram, vai kalti ar dažādām metodēm, tādējādi tiem ir produkti ar dažādām fizikālajām īpašībām.
Krāsainie: sakausējumi, ko veido cita veida metāli, piemēram, alumīnijs, varš, niķelis, cinks, titāna.
Smagie metāli: svins, niķelis, cinks, dzīvsudrabs. Tie ir reaktīvi, toksiski un bioakumulatīvi metāli. Cita starpā tos izmanto baterijās, lampās, munīcijā kara priekšmetiem.
Metālu ķīmiskās saites
Metāli ir elementi elektropozitīvs, tas ir, viņiem ir tendence zaudēt elektronus ķīmiskā saitē. Kad metāls mijiedarbojas ar nemetālu, tas veikt jonu saiti dēļ atšķirības elektronegativitāte. Otra metālu savienošanas iespēja ir metāla saites.
Plkst metāla savienojumi starp metāliem, daļēji atbrīvojoties no elektroniem un ap atomiem veidojoties elektronu mākonim vai jūrai, kas garantē metāla daļām vadītspēja elektriskā un kaļamā forma.
Skatīt arī: Diriģenti un izolatori - kādas ir atšķirības?
Metālu iegūšana
Lielākā daļa metālu ir dabiski sastopami ieži un minerāli, kas saistīti ar citiem elementiem. Ir vairāki metālu rafinēšanas paņēmieni, piemēram, izmantojot elektrolīzi un ķīmiskas reakcijas, lai atdalītu savienojumus.
Metālu gadījumā divas rūpnieciskā mērogā visbiežāk izmantotās metodes, lai iegūtu noteiktu metāla tīrības pakāpi, ir: atšķirība blīvums un magnētiskā uzņēmība (tieksme, ka metālam jāreaģē uz a magnētiskais lauks).

atrisināti vingrinājumi
Jautājums 1 - (Enem) Kadmijs, kas atrodas baterijās, var nokļūt zemē, ja šie materiāli tiek neregulāri izmesti vidē vai kad tie tiek sadedzināti. Atšķirībā no metāla formas, Cd2 + joni ir ārkārtīgi bīstami ķermenim, jo tie var aizstāt Ca2 + joni, izraisot deģeneratīvu kaulu slimību, padarot tos ļoti porainus un izraisot stipras sāpes kaulos. locītavas. Tie var arī inhibēt enzīmus, kurus aktivē Zn2 + katjons, kas ir ārkārtīgi svarīgi nieru darbībai. Attēlā parādīta dažu metālu un to attiecīgo katjonu rādiusa variācija.
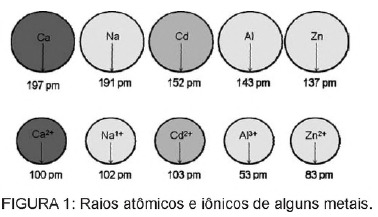
Pamatojoties uz tekstu, kadmija toksiskums jonu formā ir šī elementa sekas
A) ir zema jonizācijas enerģija, kas veicina jonu veidošanos un atvieglo tā saistīšanos ar citiem savienojumiem.
B) ir tendence darboties bioloģiskajos procesos, ko ietekmē metāliskie katjoni, kuru lādiņi svārstās no +1 līdz +3.
C) ir ar rādiusu un lādiņu salīdzinoši tuvu metāla joniem, kas iedarbojas uz bioloģiskajiem procesiem, izraisot traucējumus šajos procesos.
D) ir liels jonu rādiuss, ļaujot tam iejaukties bioloģiskajos procesos, kuros parasti piedalās mazāki joni.
E) ir +2 lādiņš, kas ļauj tam traucēt bioloģiskos procesus, kuros parasti piedalās joni ar zemāku lādiņu.
Izšķirtspēja
C alternatīva Kadmijs ir elements, kas ir līdzīgs metāla joniem, kas mums dabiski ir ķermenī. Papildus tam, ka kadmijs ir bioakumulatīvs, tas ir līdzīgs metāla grupām, tas var saistīties arī ar sulfhidrilgrupu molekulu grupām. olbaltumvielu, tādējādi izraisot izmaiņas bioloģiskajos procesos, piemēram, atkaļķošanā, kā arī audu un sarkano asins šūnu iznīcināšanā asinis.
2. jautājums - Metāliem raksturīgajām īpašībām atzīmējiet nepareizo alternatīvu.
A) Lielākā daļa metālu ir labi elektriskie un siltuma vadītāji.
B) Daži metāli ir pakļauti oksidācijai un / vai reducēšanai.
C) Dzelzs ir izturīgs un kaļams metāls, tas ir, to ir viegli pelēt.
D) Sārmu zemes metāliem ir šis nosaukums “zeme”, kas attiecas uz šo metālu oksīdiem, kuriem ir tumša krāsa.
E) Metāli ir dažādu krāsu un blāvi elementi oksidācijas iedarbības dēļ.
Izšķirtspēja
E alternatīva Metāli ir dabiski spīdīgi un metāliski, tie var oksidēties, kas izraisa izmaiņas īpašībām, kas attiecas uz daļas aspekts, taču tā nav parādība, kas notiek visos metālos, un dažos gadījumos oksidēšanās ir atkarīga no vairākiem faktoriem ārējs.
autors Laysa Bernardes
Ķīmijas skolotājs