tiek saukts jonu stars jona lielums. Šīs īpašības izpēte ir atkarīga no zināšanām par atomu rādiusu un joniem.
Atoma rādiuss: ir neitrāla atoma lieluma mērījums (teorētiskais attālums no kodola līdz pēdējai elektrosfērai).
joni: atomi, kas zaudē (katjonus) vai iegūst elektronus (anjonus).
Protoni kodola iekšpusē atoms izdarīt pievilcīgu spēku uz elektroniem (negatīvām daļiņām), kas atrodas elektrolodēs. Jo lielāks protonu skaits, jo lielāka šī pievilcība un otrādi. Kad elektronu skaitu atomā modificē šo daļiņu zudums vai pieaugums, piesaiste starp protoniem un elektroniem tiek modificēta šādi:
Katjona gadījumā:
Elektronu skaits elektrosfērās kļūst mazāks par protonu skaitu kodola iekšpusē kas kodola pievilkšanas spēku padara lielāku, tuvinot tam elektronus. elektriskās sfēras. Rezultāts ir atoma rādiusa samazināšanās. Tādējādi katjona rādiuss vienmēr būs mazāks par tā neitrālā atoma rādiusu.
Neitrāls atoma rādiuss> Katjona rādiuss
Anjona gadījumā:
Elektronu skaits elektrosfērās kļūst lielāks nekā protonu skaits kodola iekšienē. Šajā gadījumā kodola pievilkšanas spēku pārvar ar atgrūšanas spēku starp elektrosfērās esošajiem elektroniem, kā rezultātā palielinās atoma rādiuss. Tādējādi anjona rādiuss vienmēr būs lielāks par tā neitrālā atoma rādiusu.
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Anjona rādiuss> Neitrāls atoma rādiuss
Divas tālāk norādītās situācijas ir labs piemērs tam, kas notiek ar jonu rādiusu:
1.) Neitrāls nātrija atoms (11Na) un nātrija katijons (11Plkst+)
Kamēr neitrālajam nātrija atomam ir vienpadsmit protoni (dzeltenās sfēras) un vienpadsmit elektroni (sarkanās sfēras), nātrija katjonā ir vienpadsmit protoni un desmit elektroni.

Nātrija neitrālā atoma modelis
Kad neitrālais nātrija atoms zaudē elektronu, rādiuss samazinās.
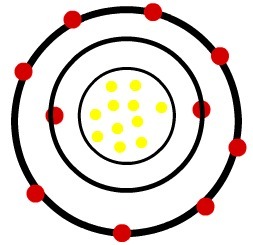
Nātrija katjona modelis
Novērojums: Trešais līmenis katjona attēlā netika attēlots, jo, tā kā tas zaudēja vienīgo elektronu, kas tam bija, tas kļuva tukšs un tāpēc netika ņemts vērā, taču tas ir klāt.
2.) fosfora neitrāls atoms (15P) un fosfora katjonu (15P-3)
Kamēr neitrālā fosfora atomā ir piecpadsmit protoni (dzeltenās sfēras) un piecpadsmit elektroni (sarkanās sfēras), fosfora anjonā ir piecpadsmit protoni un astoņpadsmit elektroni.
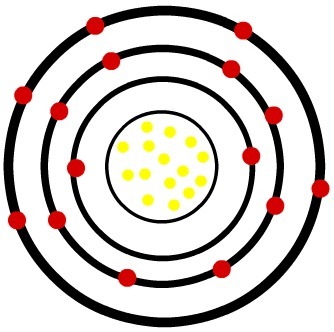
Neitrāla fosfora atoma modelis
Kad neitrālais fosfora atoms iegūst trīs elektronus, rādiuss palielinās.
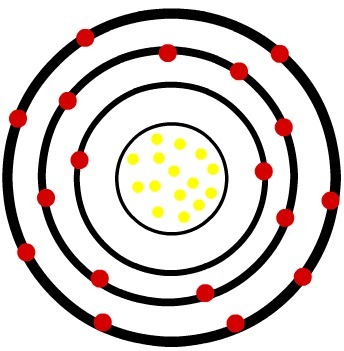
Fosfora anjona modelis
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Joniskā rādiuss"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/raio-ionico.htm. Piekļuve 2021. gada 28. jūnijam.

