O atoma rādiuss (r) parasti tiek definēts kā puse no attāluma starp diviem kaimiņu atomu kodoliem, kā parādīts zemāk redzamajā attēlā:

atomu rādiuss
Atomu rādiuss katrā atomā atšķiras pēc tā saimes un perioda periodiskajā tabulā. Attiecībā uz elementiem, kas pieder a tā pati ģimene, tā atomu rādiuss palielinās, palielinoties atomu skaitam., tas ir, no augšas uz leju. Jo šajā ziņā tas nozīmē, ka no viena atoma uz otru ir palielinājies enerģijas līmenis vai elektroniskais slānis, tāpēc tā rādiuss proporcionāli palielinās.
Attiecībā uz elementu tajā pašā periodā, tas ir, horizontāli, rādiuss palielinās no labās uz kreiso pusi vai samazinoties atomu skaitam. Tas ir tāpēc, ka viņiem visiem ir vienāds slāņu skaits, atšķirība ir to daudzumam elektroni šajos slāņos, un jo vairāk elektronu, jo lielāka ir pievilcība kodolam, tādējādi samazinot atoms.

Atoma rādiusa augšanas virziens atbilstoši ģimenei un periodam periodiskajā tabulā
Tomēr atoma rādiuss var mainīties atkarībā no izveidotā savienojuma. Apskatīsim, kā tas notiek:
* Joniskā obligācija: Ja atoms veido a katija samazināsies, tā kā viena vai vairāku elektronu zaudēšana kodols intensīvāk pievilks elektronus. Tagad ja veidojot anjonu, ti, iegūstot elektronus, atoma rādiuss palielināsies, jo kopējais elektrosfēras lādiņš būs lielāks par kodola kopējo lādiņu, samazinot tā pievilcību. Jo vairāk elektronu jūs iegūstat vai zaudējat, jo lielākas būs staru lieluma variācijas.
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
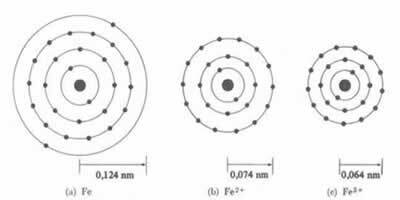
Katjona diametrs vai rādiuss vienmēr ir mazāks par atoma diametru vai rādiusu
Arī sērijā izoelektroniskie joni, kuriem ir vienāds elektronu daudzums un enerģijas līmenis, jonam ar mazāko atomu skaitli būs lielāks rādiuss. Piemēram, joni 13Al3+, 12mg2+, 11Plkst1+, 9F-1, 8O2- un 7N-3, visiem ir 10 elektroni un 2 elektroniskie līmeņi. Bet vislielākais rādiuss ir 7N-3, jo tam ir mazākais atomu skaitlis (Z = 7).
* Kovalentā saite: Kad divi atomi izveido kovalento saiti, ja abi atomi ir vienādi, tāpat kā ūdeņraža gāzes gadījumā (H2), var runāt par kovalentu rādiusu (r), kas ir puse no saites garuma (d), tas ir, puse no attāluma, kas atdala divus kodolus. Lai gan, ja saiti veido dažādi atomi, tāpat kā hlorūdeņraža (HCl) gadījumā, garums vai attālums (d) būs kovalentā iesaistīto atomu kovalento rādiusu (r1 + r2) summa.
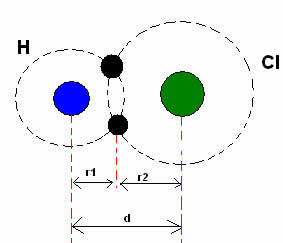
Atomu rādiusu summa kovalentajā saitē.
Protams, mums jāatceras, ka šis jautājums ir daudz sarežģītāks, jo atoma kovalentais rādiuss var mainīties, jo tas saistās ar citiem dažādiem atomiem.
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Ķīmisko saišu atomu rādiusa izmaiņas"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm. Piekļuve 2021. gada 28. jūnijam.