O nātrija hlorīds (galda sāls) ir sāls, ko mēs ikdienā izmantojam sāls ar rokām gatavotiem vai pārstrādātiem (rūpnieciski) pārtikas produktiem. Tā ir viela, kas ir arī dažādos dabiskos pārtikas produktos, kurus mēs ikdienā lietojam, piemēram, augļos, dārzeņos, pākšaugos, sēklās utt.
Šajā tekstā jūs zināt visu par šo cilvēka ikdienas dzīvē svarīgo vielu:
definīciju
Nātrija hlorīds pieder pie sāļu neorganiskās funkcijas un sastāv no nātrija katjona (Na+) tas ir anjons cturoreto (Cl-) caur a jonu saite.
b) Ķīmiskās īpašības
Nātrija hlorīdu veido divi ķīmiskie elementi:
→ Nātrijs (Na):
pieder pie metālu saimes (kas spēj viegli veidot katjonus) sārmains (AI);
valences apvalkā ir elektrons;
atomu skaitlis ir vienāds ar 11;
ir augsta elektropozitivitāte (spēja zaudēt elektronus).
→ Hlors (Cl)
pieder halogēnu ģimenei (VIIA);
tas ir nemetāls (tāpēc tas tik viegli kļūst par anjonu);
valences apvalkā ir septiņi elektroni;
atomu skaitlis ir vienāds ar 17;
ir augsta elektronegativitāte (spēja iegūt elektronus).
Tā kā divi ķīmiskie elementi, kas veido nātrija hlorīdu, ir attiecīgi augsti elektropozitīvi un augsti elektronegativitāte, starp tām pastāv jonu saite (izveidojusies starp atomiem ar tieksmi zaudēt un iegūt elektroni).
Nātrija hlorīda ķīmisko struktūru veido viens hlorīda anjons (zaļā sfēra), kas mijiedarbojas ar sešiem nātrija katjoniem (zilās sfēras), kā redzams zemāk esošajā struktūrā:
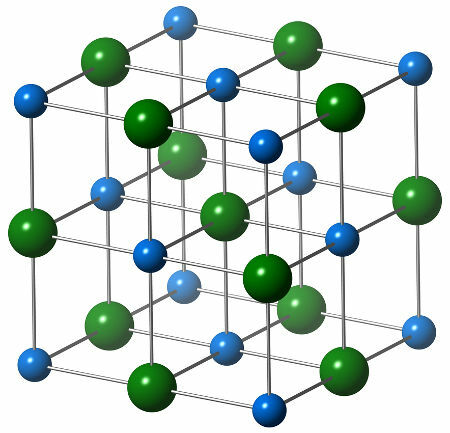
Nātrija hlorīda kristāla struktūras attēlojums
c) Fiziskās īpašības
Kodolsintēzes punkts:
Nātrija hlorīdu var pārveidot no cietā stāvokļa šķidrā stāvoklī 801 temperatūrā OÇ.
Vārīšanās punkts:
Nātrija hlorīdu 1465 temperatūrā no šķidruma var pārveidot par gāzveida stāvokli OÇ.
Polaritāte
Tā kā tā ir viela, kuru radījusi jonu saite, tas ir, tāpēc, ka tas ir jonu savienojums, nātrija hlorīds ir polārs.
Šķīdība ūdenī
Mēs varam izšķīdināt 1 L ūdens, 25 ° C temperatūrā OC, līdz 359 gramiem nātrija hlorīda.
Šķīdība citos šķīdinātājos:
Tā kā nātrija hlorīds ir polārs savienojums, to nevar izšķīdināt nevienā nepolāra rakstura šķīdinātājā, piemēram, eļļā.
Blīvums:
Nātrija hlorīda blīvums ir 2,165 g / ml, tāpēc tas ir blīvāks par ūdeni, kura blīvums ir vienāds ar 1 g / ml.
Elektrovadītspēja:
Tā kā tas ir jonu savienojums, nātrija hlorīds spēj vadīt elektrisko strāvu tikai tad, ja:
-
Tas ir izkausētā stāvoklī, tas ir, šķidrs;
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Izšķīdis ūdenī.
d) iegūšanas metodes
Nātrija hlorīdu var iegūt fizikāli vai ķīmiski:
1O) Fiziskā iegūšana:
frakcionēta kristalizācija
Nātrija hlorīdu iegūst, iztvaicējot ūdeni no okeāniem.
pazemes mīnas
To iegūst raktuvēs, izmantojot ieguves paņēmienus.
pazemes noguldījumi
To iegūst no dziļiem pazemes nogulumiem, izšķīdinot ūdenī (nogulsnē esošais sāls izšķīst) un pēc tam sūknējot.
2O) Ķīmiska iegūšana
sintēzes reakcija
Nātrija hlorīdu var iegūt ķīmiskās sintēzes reakcijā (no vienkāršām vielām rodas savienojums) starp hlora gāzi un metālisko nātriju:
2 collass) + Cl2. punkta g) apakšpunkts → 2 NaCls)
Neitralizācijas reakcija:
Vēl viens veids, kā ķīmiski iegūt nātrija hlorīdu, ir neitralizācijas reakcija starp sālsskābi un nātrija hidroksīdu, kurā veidojas sāls un ūdens:
HCl(1) + NaOH(šeit) → NaCl(šeit) + H2O(1)
e) Nozīme cilvēkiem
Nātrija hlorīdam pašam nav funkcijas cilvēka ķermenī, bet, kad tas disociējas nātrija katjonos (Na+) un hlorīda anjoni (Cl-), katram no šiem diviem joniem ir vairākas svarīgas funkcijas mūsu ķermenim. Skatiet dažas no šīm funkcijām:
→ Nātrija katjona funkcijas (Na+)
Novērš asins recēšanu;
Cīnās ar nieru un žultsakmeņu veidošanos;
Piedalās ķermeņa šķidrumu regulēšanā;
Piedalās asinsspiediena regulēšanā.
→ Hlorīda anjona funkcijas (Cl-)
Dalība kuņģa sulas veidošanā un izveidošanā (sālsskābe - HCl);
Dalība aizkuņģa dziedzera sulas veidošanā.
f) Bojājumi cilvēka ķermenim
Pārmērīgs nātrija hlorīda patēriņš cilvēkiem var nodarīt šādu kaitējumu:
→ Bojājumi, ko organismā rada pārmērīgi daudz nātrija katjonu:
Palielināts brūču sadzīšanas laiks;
Palielināta saslimstība ar krampji;
Paaugstināts asinsspiediens;
Nieru pārslodze;
Paaugstināta šķidruma aizture organismā.
→ Bojājumi, ko organismā izraisa liekie hlorīda anjoni:
iznīcināšana E vitamīns;
Joda ražošanas samazināšanās organismā.
g) Citi pielietojumi
Papildus izmantošanai sāls ēdienam, nātrija hlorīdu var izmantot arī šādās situācijās:
Šampūnu ražošana;
Papīra ražošana;
Ražošana Nātrija hidroksīds (NaOH);
Mazgāšanas līdzekļu ražošana;
Ziepju ražošana;
Sniega kušana vietās, kur cieš putenis;
Metāliska nātrija ražošana;
Hlora gāzes ražošana;
Izotonikā ķermeņa elektrolītu nomaiņai;
Deguna dekongestantu šķīdumos;
Fizioloģiskā šķīduma ražošana; starp citiem lietojumiem.
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Nātrija hlorīds (galda sāls)"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/cloreto-sodio.htm. Piekļuve 2021. gada 27. jūnijam.
Jonu savienojumi, jonu savienojumu galvenās īpašības, saikne starp joniem, galīgā elektronu pārnese, elektrostatiskās pievilkšanās spēki starp joniem, negatīvie un pozitīvie joni, anjoni, katjoni, jonu saites, molekulārā struktūra viņš
Ķīmija

Jonu saite, sakari starp jonu savienojumiem, jonu aglomerātiem, nātrija hlorīdu, galda sāli, jonu vielu, elektrostatiskās pievilkšanās spēki, hlorīda anjoni, nātrija katijoni, polārie šķīdinātāji, pozitīvie joni, katjoni, negatīvie joni, anjoni.

