Sālsskābe ir ūdeņražskābe ar augstu jonizācijas potenciālu, tas ir dzeltenīgs šķidrums, ļoti kodīgs un toksisks. To lieto dažādos rūpnieciskos procesos, piemēram, tīrīšanas līdzekļu un farmaceitisko hidrohlorīdu ražošanā, pārtikā un tērauda ražošanas procesos.
Tas atrodas arī cilvēka organismā; O kuņģa sula kas darbojas gremošanas procesā olbaltumvielas ir skābes šķīdums; sālsskābes un citu vielu, piemēram, fermenti un sāļi. Iedarbība, ieelpošana vai norīšana Koncentrēta sālsskābe ir ļoti kaitīga veselībai, kas var izraisīt pat nāvi.
Lasiet arī: Sērskābe - viela, kurai ir augsta kodīga jauda
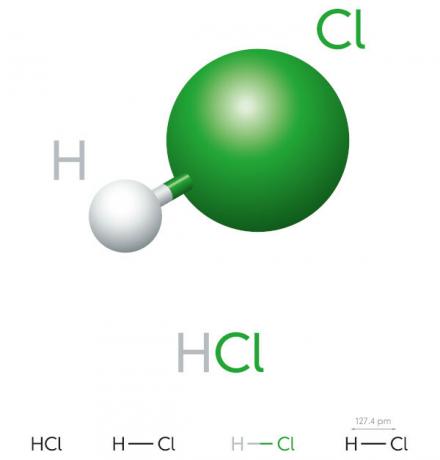
Sālsskābes īpašības
- neorganisks savienojums
- stipra skābe
- Augsts jonizācijas potenciāls
- Šķidrums
- dzeltenīgs izskats
- Toksisks
- Kodīgs
- Nepastāvīgs
- Higroskopisks (mēdz absorbēt áūdens videi)
- Šķīst ūdenī
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Sālsskābes ražošana
Sālsskābe bija atklāja musulmaņu alķīmiķis sauc Jabir Ibne Haiane, kas pazīstams arī kā Gabers un tiek uzskatīts par arābu ķīmijas tēvu. Viņš sintezēja vielu, pamatojoties uz a
reakcija starp jūras sāli (NaCl) un sērskābe (Plkst2TIKAI4).2NaCl + H2TIKAI4 → In2TIKAI4 + 2HCl
Pašlaik sālsskābe tiek ražots lielā apjomā caur elektroniskaólizēšana nātrija hlorīda ūdens šķīdumā. No šī procesa tiek iegūta gāze hlors (Cl2), gāze ūdeņradis (H2) un nātrija hidroksīds (NaOH). Hlora un ūdeņraža gāzes reaģē, veidojot sālsskābi:
Cl2 + H2 → 2HCl
Tomēr šī reakcija ir ārkārtīgi eksotermisks un ļoti bīstami. Pašlaik lielākā daļa rūpnieciski saražotās sālsskābes ir saistīta ar organisko savienojumu ražošanu, kas ir ekonomiskāks un drošāks process.
R-H + Cl2 → R-Cl + HCl
(Uzskatiet R par organisku radikāļu.)
Skatīt arī: Padomi, lai noteiktu-ja skābju stiprums

Sālsskābes lietošana
- Metāla kodināšana: Sālsskābi izmanto metālu “attīrīšanai” pirms to apstrādes, noņemot no to virsmas rūsu, zvīņas un citus piemaisījumus.
- Organisko savienojumu ražošana: sālsskābi izmanto kā reaģentu, lai iegūtu vinilhlorīdu, ko izmanto plastmasas ražošanā. Sālsskābe nāk arī no hloroprēna, ko izmanto sintētiskajās gumijās.
- Neorganisko savienojumu ražošana: sālsskābe ir sastopama vairākos rūpnieciskos procesos reaģentu un savienojumu ražošanai Neorganiski produkti, tostarp ūdens apstrādes produkti, piemēram, dzelzs (III) hlorīds un dzelzs (III) hlorīds. alumīnijs.
- Izmanto kā tīrīšanas līdzekli: Sālsskābi, kas tiek pārdota arī kā muriatīnskābe, izmanto instrumentu un mehānismu tīrīšanai pēc celtniecības, mājas un ķīmiskās tīrīšanas.
- Ēdiena pārstrāde: Sālsskābi izmanto dažādās pārtikas un piedevu ražošanas reakcijās, piemēram, cietes un olbaltumvielu hidrolīzē, vai gala produktā pH līdzsvaram.
- Zāļu ražošana: Sālsskābi izmanto šķīstošo hidrohlorīdu ražošanā, kas atrodas vairākās zālēs, piemēram, doksiciklīna hidrohlorīdā, ko lieto vēdertīfs un bakas.
Sālsskābe organismā
Sālsskābe ir mūsu sastāvā gremošanas sistēma, kuņģa sula, ko ražo mūsu kuņģis, ir ūdens, enzīmu, sālsskābes, neorganisko sāļu un neliela daļa pienskābes šķīdums.
O pārtikas kūka tiek pārveidota par chyme, skāba masa (pateicoties kuņģa sulas iedarbībai un tās skābajam sastāvam), tieši tad sagremošana olbaltumvielas, pārveidots par polipeptīdi un aminoskābes ko absorbēs ķermenis.
Sālsskābes bīstamība
Sālsskābe ir ļoti spēcīga un kodīga skābe, tāpēc saskare ar vielu rada vairākus bojājumus:
- Āda: Izraisa apdegumus un kairinājumu.
- Acis: Izraisa smagu kairinājumu un var izraisīt aklumu.
- Ieelpošana: Izraisa kairinājumu un ievainojumus augšējos elpceļos.
- norīšana: izraisa koroziju visā mutes sistēmā un kuņģa-zarnu traktā, tas var izraisīt vemšanu, asiņošanu, caureju, asinsrites traucējumus, kas var izraisīt nāvi.
- Iedarbībaturpinājums sekos: vispirms uzbrūk gļotādas zonām, izraisot dermatītu un konjunktivīts, smaganu asiņošana, fotosensibilizācija; bieža ieelpošana var izraisīt pat zemu savienojuma koncentrāciju gastrīts un deguna asiņošana.
Piekļūstiet arī: Etiķskābes raksturojums un īpašības

atrisināti vingrinājumi
Jautājums 1 - (Udesc) Attiecībā uz sālsskābi var teikt, ka:
A) atrodoties ūdens šķīdumā, tas ļauj iziet elektrisko strāvu.
B) ir skābes.
C) ir vāja skābe.
D) ir zema jonizācijas pakāpe.
E) ir jonu viela.
Izšķirtspēja
A alternatīva Sālsskābe nav skābe, jo tajā ir tikai viens jonizējamais H, bet viens stipra skābe, molekulāra viela ar augstu jonizācijas potenciālu. jonizācija ūdens vidē veicina elektriskā strāva brīvo jonu esamības dēļ.
2. jautājums - Sālsskābes un ūdens šķīdumā mēs varam teikt, ka molekulārā ūdeņraža hlorīda (HCl) sastopamība ir minimāla, tas ir tāpēc, ka
A) sālsskābi, kas nonāk saskarē ar ūdeni, atšķaida.
B) ūdeņraža hlorīds ir viela, kas nešķīst ūdenī.
C) ūdeņraža hlorīdam ir augsts jonizācijas potenciāls, tāpēc, atrodoties ūdens vidē, HCl molekula veido H jonus+ Cl-.
D) sālsskābe, jo tā ir ļoti gaistoša, atdalās no šķīduma, atstājot tikai ūdens molekulas.
E) sālsskābe ir jonu viela, tāpēc ūdens šķīdumā tā disociējas, veidojot jonus.
Izšķirtspēja
C alternatīva
A) Atbilde nepiekrīt jautājumam, sālsskābes atšķaidīšana ūdenī neattaisno molekulārā HCl neesamību.
B) Nepareizi, ūdeņraža hlorīds ir šķīstošs un tam piemīt afinitāte pret ūdeni.
C) Pareizi
D) Lai arī sālsskābe ir gaistoša, šī divu sugu nošķiršana šķīdumā būtiski nenotiek.
E) Sālsskābe ir hlorūdeņraža un ūdens šķīdums, kur sālsskābe ir nejonu molekulāra viela.
Autors Laysa Bernardes Marques de Araujo
Ķīmijas skolotājs
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
ARAúJO, Laysa Bernardes Marques de. "Sālsskābe"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. Piekļuve 2021. gada 27. jūnijam.

